TREG与FOXP3:2025诺贝尔生理学或医学奖解读
- 2025-10-20
- 466
2025年诺贝尔生理学或医学奖授予了三位免疫学家以表彰他们在外周免疫耐受机制方面的开创性发现,他们分别是玛丽·E·布伦科(Mary E. Brunkow)、弗雷德·拉姆斯德尔(Fred Ramsdell)和坂口志文(Shimon Sakaguchi)[1]。他们的研究揭示了生物体内的免疫系统在攻击外来病原体时,不会对自身细胞组织进行攻击的原因和机制。这一发现为推进自身免疫疾病、肿瘤免疫治疗以及改善器官移植排异反应等研究提供了理论基础。
一、获奖者介绍

图1 2025年诺贝尔生理学或医学奖获得者
1. 玛丽·E·布伦科(Mary E. Brunkow):来自美国,就职于美国西雅图系统生物学研究所。主要研究方向为免疫学和系统生物学,包括莱姆病、骨质疏松症等复杂疾病的基因组学和生物医学项目。
2. 弗雷德·拉姆斯德尔(Fred Ramsdell):来自美国,就职于美国旧金山索诺玛生物治疗公司。主要研究方向为免疫学,包括将基础免疫学发现转化为调节性T细胞疗法,用于治疗自身免疫病和癌症。
3. 坂口志文(Shimon Sakaguchi):来自日本,就职于日本大阪大学免疫学前沿研究中心。主要研究方向为免疫学,包括解析Foxp3蛋白的稳定机制,积极探索将调节性T细胞疗法与现有的PD-1/PD-L1抑制剂等免疫检查点疗法相结合,开发抗体药物以期提高癌症的治疗效果。
二、外周免疫耐受机制

图2 Foxp3和TREG关系
1.调节性T细胞的发现
免疫耐受是指免疫系统对抗原的刺激不产生特异性免疫应答的现象。在坂口志文教授作出突破之前,科学界普遍认为免疫耐受主要通过胸腺的“中枢耐受”进行调节,即在胸腺中清除可能攻击自身组织的免疫细胞。
然后,坂口志文教授通过实验发现,在未触发自身免疫疾病的生物体中,经过胸腺的筛选之后外周血液循环和组织中仍会存在可能会攻击自身组织的免疫细胞。因此证明了体内存在着一类特殊的T细胞可以抑制这类免疫细胞,进而保护机体免受自身免疫疾病的侵害,并将其命名为调节性T细胞(Regulatory T Cells,TREG)[2]。
2. Foxp3基因的锁定
在确定了特殊T细胞的存在后,需要对其具体作用进一步进行验证。布伦科教授和拉姆斯德尔教授对患有自身免疫疾病小鼠(Scurfy突变小鼠)的研究中,发现并证实Foxp3基因的突变会导致小鼠免疫系统的失控,进而引发小鼠的自身免疫疾病。
随后,他们还发现人类中Foxp3基因的突变会导致一种罕见且致命的自身免疫疾病——IPEX。从人类遗传学角度进一步证明了Foxp3基因对于维持自身免疫平衡的核心作用[3]。
3. 外周免疫耐受机制的建立
在确定Foxp3基因可以与自身免疫疾病存在联系后,坂口志文教授通过研究证明了Foxp3基因为调控调节性T细胞发育和功能的决定性基因。当Foxp3基因发生突变后,生物体的免疫系统就会发生混乱,触发包括Colitis和Gastritis在内自身免疫疾病[4]。
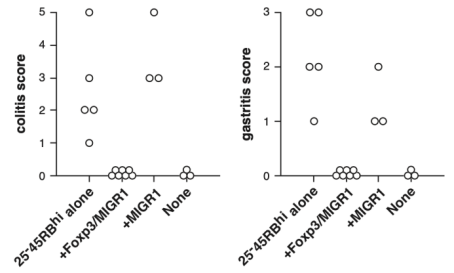
图3 Colitis和Gastritis系数[4]
三位教授的工作共同建立了外周免疫耐受机制的完整链条,即在胸腺之外,生物体还拥有一套精密的免疫系统来维持免疫平衡。
三、核心技术与应用
外周免疫耐受机制的阐明依赖于关键的生物技术,其中包括:
1. 流式细胞术与细胞分选:坂口志文教授利用该技术,通过对细胞表面标志物进行分析,完成了对调节性T细胞群体的识别和鉴定。
2. 基因定位与动物模型:布伦科教授与拉姆斯德尔教授利用基因定位技术从小鼠疾病模型定位并找候选基因,再通过构建Foxp3基因敲除小鼠,直接证明了该基因的缺失可以导致调节性T细胞失活进而引发自身免疫疾病。
3. 特异性抗体与细胞系模型:特异性抗体可以帮助定位和关联具体的调控机制,比如可以用于检测Foxp3蛋白的表达和TREG细胞的关系,进而关联表型和基因型;而细胞系模型的构建可以使整个研究在可控环境下深入解析其详细的分子调控机制。
这项基础科学的突破,为许多疾病的治疗带来了新策略:
1. 自身免疫疾病:通过生产自身免疫相关的抗体,调节并降低外周免疫耐受过程中调节性T细胞的活性,进而消除错误的自身免疫过程。
2. 癌症免疫治疗:通过开发特异性靶向并清除肿瘤微环境中的调节性T细胞的抗体药物,增强生物体内的免疫系统,进行肿瘤免疫治疗。
3. 器官移植:在器官移植过程中,可以通过对调节性T细胞进行改造使其特异性聚集到移植的器官中,局部抑制排异反应。
上述关键技术的发展与应用,推动了免疫领域的药物研发进程。以卡梅德生物(KMD Bioscience)为例,正是基于这些技术平台(如噬菌体展示文库构建与筛选、单B细胞抗体制备等),加速了针对TREG细胞相关靶点(如CD25, CTLA-4等)的创新抗体药物的研发进程,促进了免疫疾病的治疗。
四、总结
外周免疫耐受机制的阐明不仅是生命基础科学的里程碑,更促进了自身免疫疾病、肿瘤免疫治疗和器官移植的研发进程。随着对TREG细胞调控机制的深入了解,新型免疫疾病的治疗也进入了新阶段。
参考文献
[1] https://www.nobelprize.org/prizes/medicine/2025/press-release/
[2] Sakaguchi S , Sakaguchi N , Asano M ,et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J]. Journal of Immunology, 1995, 155(3):1151.DOI:doi:10.1177/1753425910361989.
[3] Brunkow M E , Jeffery E W , Hjerrild K A ,et al. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse[J]. Nature Genetics, 2001, 27(1):68.DOI:10.1038/83784.
[4] Hori S , Nomura T , Sakaguchi S. Control of Regulatory T Cell Development by the Transcription Factor Foxp3[J]. Science, 2003, 299(5609):1057-1061.DOI:10.1126/science.1079490.
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





