抗体亲和力成熟的应用前景
- 2025-11-12
- 165
一、背景介绍
抗体是机体发挥针对特定病原精准识别和杀伤作用的主要武器,其中抗体亲和力更是直接影响了它的生物学功能效能。将其用于疾病诊疗或者基础研究时,会比天然状态下对抗体的亲和力有更高的要求,这就需要用到我们的抗体亲和力成熟技术来实现利用实验室条件把低亲和力抗体转变成具有超高亲和力和极高特异性的抗体,并在此基础上使抗体兼具适宜的药代动力学特性,在此基础上对抗体的可利用范围起到了显著的拓宽作用,极大程度地降低了目前已有的抗体药物的毒副作用,也在很大程度上推动了未来抗体偶联药物ADC、CAR-T中的嵌合抗原受体、新型纳米抗体等方向的发展。
二、VHH纳米抗体
VHH抗体是在骆驼科动物和鲨鱼中发现的一种独特的单域抗体,与传统抗体相比缺乏轻链和CH1区,可变区只包含1个VHH片段。VHH抗体的分子量仅为传统抗体的10%,具有穿透致密组织的能力,并且能够深入渗透肿瘤以及穿过血脑屏障,规避了传统抗体体积大、稳定性低的缺点,在疾病诊断和治疗方面展现出潜在的应用价值。
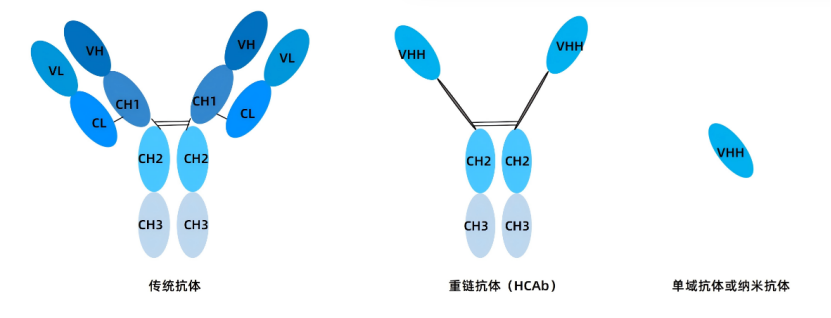
图1 VHH抗体结构示意图
三、抗体亲和力成熟
亲和力成熟作为提高抗体与靶点结合能力的重要步骤,通过对抗体的互补决定区(CDR)进行定点改造,提升抗体与靶标的结合力及特异性,在文库构建→突变引入→高通量筛选链路中搭建起免疫源、解析数据库得到初始序列、初筛阳性克隆、获得胚系基因、采用错配PCR保留天然多样性的基础文库。采用三核苷酸突变法引进步长可调、精度更佳的可调控突变方法,构建规模达10⁸-10¹¹的噬菌体/酵母展示库。其中突变引入策略包含理性设计和定向进化方式。最后利用高通量筛选得到高亲和力序列。目前该现代技术平台已经实现了第1个闭环体系,即AI预筛和自动分拣,将原来6个月的周期成功缩短为4周。
四、VHH抗体亲和力成熟
在体内免疫反应过程中,为了增强免疫球蛋白识别和结合外来抗原的能力,抗体H链在经历V-D-J基因片段重组后,B细胞通过在生发中心进行类别转换重组(CSR)并在CDR中经历体细胞超突变(SHM)来实现体内亲和力成熟。VHH抗体的独特性使其更适用于体外亲和力成熟策略。目前易错PCR、DNA改组、链置换等多种抗体体外亲和力成熟策略已被广泛应用。
与传统抗体相比,VHH抗体的CDR区表现出更多的结构多样性,其中CDR-H3环在抗原识别过程中担任关键角色。因此,突变或者改造VHH抗体的CDR区是最关键的方式,可以通过将特异性CDR嫁接到骆驼科动物的VHH可变结构域的CDR中,来增强抗体的结合亲和力。我们还可以基于合成纳米抗体库支架c Ab BCII10来构建合成噬菌体文库并在VHH的CDR3中引入随机序列来获得具有更高亲和力的VHH抗体。
五、抗体亲和力成熟药物开发应用
抗体亲和力成熟技术正在深刻地改变着治疗性抗体的研发格局,其主要应用场景包括:
1.实体瘤靶向治疗:产生高亲和力抗体以克服致密基质层与低表达异质性靶点。例如经过亲和力优化的抗PD-L1纳米单抗,肿瘤穿透能力提高5倍,导致KN046比对照组生存期更长。
2.双特异性抗体的设计:通过差异化亲和力调控来达到靶向协同效应,其中CD3×肿瘤抗原的双抗设计会由于降低对CD3的亲和力而降低T细胞过活化的毒副作用,又因为增强对肿瘤抗原的超亲和力而增加靶向效率,能够把卵巢癌客观缓解率从单抗的28%增加到54%。
3.胞内抗体开发:利用亲和力成熟突破传统抗体胞内递送的瓶颈,将基于纳米抗体的PROTAC降解剂CDR3区域优化,可以将胞内结合能力提高8倍,PDX肺癌模型诱导突变蛋白降解率达到92%,用于不可成药靶点。
针对抗体类药物对高亲和力的需求,卡梅德生物通过整合噬菌体展示、酵母展示、定向进化、AI辅助设计等生物技术手段,建立超大规模的突变库,采用FACS、SPR等高灵敏度筛选手段,提高几十倍到上千倍的抗体亲和力,尤其擅长纳米抗体领域。卡梅德生物拥有丰富经验的国际化人才队伍、灵活的个性化方案以及传统抗体与纳米抗体的双优化平台,加速您从候选分子到临床前研究。
参考文献
[1] Chaudhuri D, Majumder S, Datta J, Giri K. Designing of nanobodies against Dengue virus Capsid: a computational affinity maturation approach. J Biomol Struct Dyn. 2023; 41(6): 2289-2299.
[2] Yu H, Mao G, Pei Z, et al. In Vitro Affinity Maturation of Nanobodies against Mpox Virus A29 Protein Based on Computer-Aided Design. Molecules. 2023; 28(19): 6838.
[3] Lowden MJ, van Faassen H, Raphael S, Ryan S, Hussack G, Henry KA. Facile Affinity Maturation of Single-Domain Antibodies Using Next-Generation DNA Sequencing. Methods Mol Biol. 2022; 2446: 245-268.
常见问题解答
Q1:纳米抗体亲和力成熟如何突破传统抗体药物开发瓶颈?
A1:纳米抗体亲和力成熟通过定向进化技术,如酵母展示、噬菌体展示技术,来筛选皮摩尔级(pM)高亲和力变异体,突破传统抗体药物两大核心瓶颈:其一,其单域结构及长CDR3环可识别传统抗体无法触及的隐藏表位,如GPCR跨膜区凹槽、离子通道变构口袋,解决“不可成药”靶点结合力不足问题;其二,凭借小分子量(约15 kDa)及强组织穿透性,显著提升在实体瘤致密基质中对低丰度靶点的捕获效率,克服IgG类药物因分子量大导致的渗透壁垒,同时利用被动靶向(EPR效应)增强瘤内富集浓度。该技术将靶点识别范围从细胞表面扩展至复杂膜蛋白及胞内结构域,为创新抗体药物开发提供新路径。
Q2:纳米抗体亲和力成熟的核心技术有哪些革新?
A2:纳米抗体亲和力成熟的技术革新聚焦于人工智能驱动设计与超高通量筛选的融合突破。利用 AlphaFold2/ESM-2 等AI工具精准预测CDR区热点突变位点,实现计算机理性设计替代传统随机诱变,显著提升突变效率并降低功能损伤风险。结合微流控单细胞分选技术,可在单细胞层面实时分析109级超大容量突变库的结合动力学,从海量变异体中高效捕获稀有高亲和力克隆。同步整合深度突变扫描(DMS)技术,通过系统量化每个氨基酸位点替换对亲和力的影响,绘制全位点能量景观图,精准识别协同增效突变组合,将抗体解离常数优化幅度提升至1000倍以上。此技术闭环从AI预测、超大库构建到DMS功能验证,将传统需数月的成熟周期压缩至数周,且保障了纳米抗体的高稳定性与低免疫原性。革新成果已应用于靶向复杂表位的纳米抗体开发,为实体瘤穿透性疗法提供新一代高特异性工具。
Q3:高亲和力纳米抗体如何增强靶向药效?
A3:高亲和力纳米抗体通过其独特的结构优势显著增强靶向药效。以抗HER2纳米抗体(KD=50 pM)为例,其超小分子量(15 kDa)和长CDR3环(18个氨基酸)可深入肿瘤组织间隙,使抗体偶联药物(ADC)的旁观者效应提升3倍,有效克服肿瘤异质性。在免疫治疗领域,抗PD-L1纳米抗体(KD<10 pm="">)凭借高渗透性突破免疫抑制性微环境屏障,通过精确结合PD-L1的FG环表位,结合自由能降低42%,将T细胞浸润效率较传统IgG抗体提高40%。这种增强效应源于两方面机制:一是纳米抗体可避免FcγR介导的巨噬细胞吞噬,延长瘤内滞留时间;二是其稳定的β-桶状结构能耐受肿瘤微环境的酸性条件,确保持续阻断PD-1/PD-L1信号通路。最新临床数据显示,基于纳米抗体的双特异性T细胞衔接器在HER2+乳腺癌中实现客观缓解率75%,远超传统ADC药物。
Q4:为何纳米抗体更容易实现多特异性药物开发?
A4:(1)结构简化:单域VHH抗体(约15 kDa)通过柔性连接子可高效串联构建三特异性抗体(分子量<80 kda="">
(2)靶向自由度:每个VHH可独立靶向不同表位,且不含Fc结构域,规避FcγR介导的巨噬细胞过度活化,使细胞因子释放综合征风险降低70%以上。
(3)药代优化:小分子量减少肾脏清除,结合抗HSA纳米抗体延长模块可进一步延长至100小时,平衡渗透性与长效作用。
(4)协同增效:临床前模型显示三特异性纳米抗体可同步阻断免疫抑制信号、激活T细胞杀伤并靶向递送毒素,使肿瘤消退率较双抗提升50%。该技术突破传统多抗的工艺与毒性瓶颈,为实体瘤提供模块化治疗新范式。
Q5:如何解决高亲和力导致的靶向毒性?
A5:为解决高亲和力抗体药物引发的靶向毒性问题,需整合以下三重策略:
(1)采用表位门控设计,通过定向进化筛选仅在肿瘤微环境特异性激活的构象表位,实现正常组织中的“沉默”状态。
(2)实施亲和力滴定技术,利用深度突变扫描(DMS)精准调控CDR区关键残基,将KD值优化至1-10 nM范围,平衡靶点结合力与脱靶风险。
(3)结合瞬时作用机制,引入PROTAC降解模块,强制降解膜靶蛋白以终止信号持续激活,临床前模型证实该策略使IL-6等CRS相关因子释放降低80%。
- 抗体亲和力成熟
- VHH抗体
- 抗体开发
- 噬菌体文库
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





