浅谈抗体偶联药物(ADC)发现
- 2025-11-05
- 274
一、背景
ADC药物开发始于靶点选择与抗体筛选,需筛选出肿瘤细胞上特异性高表达的靶抗原并且是具有高亲和力、高效的内化的单抗。同时设计连接子需要在血液循环中稳定,在肿瘤微环境条件下能够被特异性切割;载荷选择高效载荷类,相对于传统化疗药物提高百倍以上的细胞毒性。通过定点偶联方法将各个组分按照一定比例进行组装,严格把控DAR值来达到最佳药效与安全性的平衡。最终经过系统的临床前研究验证其靶向性、有效性与安全性后,推进至临床阶段全面评估其在人体内的药代动力学特征、治疗效果及不良反应。
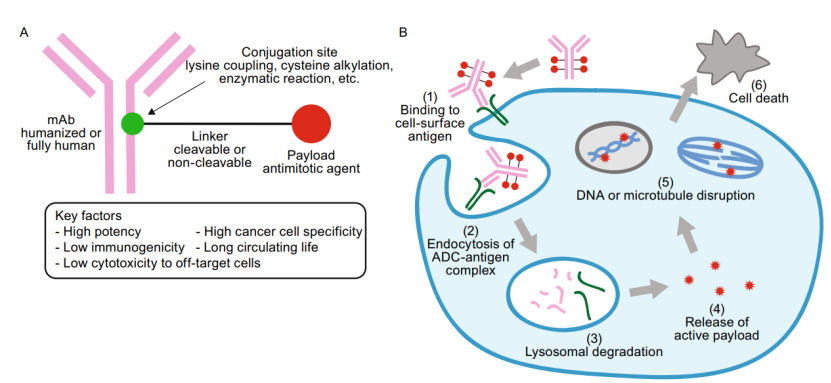
图1 抗体药物偶联物的结构与作用机制图
二、靶点选择与抗体工程
从靶点选择上讲,首先要考虑肿瘤细胞表面抗原的特异性表达水平、内化程度以及表达均一性,即最好的靶点是肿瘤组织中高表达而正常组织不存在或者表达极少。抗体工程主要是针对高亲和力、强内化的候选抗体进行人源化改造以降低抗体自身免疫原性,对Fc段进行改造优化以增加或降低与FcγR的结合能力从而达到较好的疗效及较少的毒副作用,并且借助定点偶联引入非天然氨基酸等技术为后面做出均一性更好的ADC药物打下基础,最后获得高效的靶向性及良好的成药性抗体分子。
三、连接子技术
ADC药物开发过程中的核心在于连接子的设计,直接关系着ADC药物的安全性和有效性,目前主要有可裂解和不可裂解两大类:
1.可裂解连接子根据肿瘤微环境特点选择性裂解实现载药特异性释放,如pH敏感腙键连接子、GSH裂解二硫键连接子、组织蛋白酶裂解肽链连接子等。
2.不可裂解连接子需要依赖抗体经过溶酶体降解后才能将活性代谢物释放出来,因此具有较好的血浆稳定性,但要求靶点具有较高的内化效率。
基于新一代连接子技术的发展,选择加入聚醚来减少ADC药物由于自身聚集性带来的不利影响。专门的定点偶联专用连接子来固定和把控药物与抗体的偶联比例。通过完善和优化解离动力学来寻求最优值的血浆半衰期以及癌细胞内的有效载荷释药时间是目前提高ADC药物开发治疗窗的最主要方法。
四、偶联工艺
ADC抗体偶联工艺的核心目标是将抗体、连接子与有效载荷以可控方式高效结合。当前主流工艺包括:
1.基于赖氨酸随机偶联,通过抗体表面多个赖氨酸残基与活化酯连接子反应,操作简便但易产生DAR值不均一的异质混合物;
2.基于半胱氨酸定点偶联,通过还原抗体链间二硫键产生特异性巯基进行偶联,可获得DAR值为2/4/8的较均质产物;
3.基因工程定点偶联,通过引入非天然氨基酸或特定标签实现精确偶联,显著改善ADC抗体偶联的均质性和药代动力学特性。
五、ADC药效优化挑战
ADC药物药效优化是决定ADC能否实现临床转化的关键,这一过程面临多重挑战:
1.治疗窗口调控需精准平衡疗效与毒性,既要维持足够高DAR值确保杀伤效力,又要避免因过高载药量导致聚集和系统性毒性;
2.肿瘤异质性要求ADC具备克服抗原低表达细胞群的能力,可通过优化旁观者效应实现;
3.靶点内化效率与溶酶体转运效率直接影响有效载荷释放,需筛选高效内化抗体并优化连接子裂解特性;
4.肿瘤微环境屏障制约ADC渗透分布,可通过抗体工程减小分子尺寸或开发片段化ADC改善穿透性;
5.耐药机制涉及药物外排泵上调及靶点突变,需开发新型载荷与双靶点策略应对。利用定点偶联技术控制DAR的均一性、条件性激活前药策略以及合理的连接子亲疏水平衡等新颖方式正在推动ADC药效取得新突破。
基于卡梅德生物自主研发的羊驼纳米抗体平台以及全人源抗体文库为基础,能够筛选出高亲和力、高稳定性靶向抗体。采用定点偶联技术平台,可以实现严格控制药物抗体比、位点特异性偶联,显著提高ADC抗体偶联产品均一性与稳定性的效果。我们建设了完善的药效评价体系,包括从分子水平、细胞水平、动物模型等方面进行检测,能够为客户提供从靶点验证到候选分子确定的一站式服务。
引用:
[1] Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018;9(1):33-46. doi:10.1007/s13238-016-0323-0
- ADC药物开发
- 定点偶联技术
- 抗体偶联药物
- 候选分子
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





