单链抗体(scFv)文库构建全流程
- 2025-11-28
- 210
一.单链抗体
单链抗体是人为改造而来,由全长抗体的重链可变区和轻链可变区通过短肽连接而成,且不含Fc片段,分子量比较小,是IgG抗体重量的1/6。在重组抗体制备前期,我们可以通过免疫动物得到靶向抗原的抗体序列,通过PCR扩增得到重链可变区及轻链可变区序列,用scFv连接肽进行连接并插入到噬菌体载体中进行体外展示,在众多噬菌体中用靶标筛选到高亲和力的scFv抗体序列。卡梅德生物在scFv抗体-噬菌体库构建时采用M13噬菌体展示系统,将scFv抗体基因插入到PⅢ基因中,与G3P蛋白进行融合表达,将单链抗体片段展示在M13噬菌体表面,如图1所示:
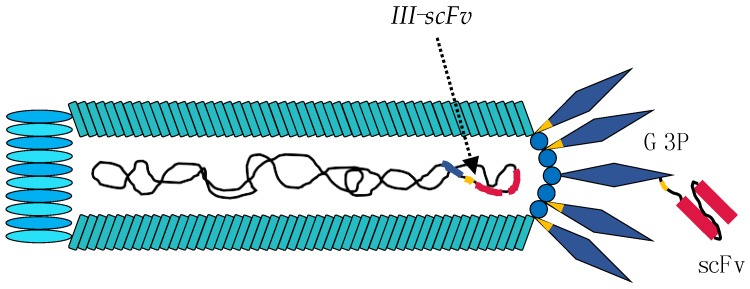
图1 M13噬菌体展示scFv抗体(文献[2])
二.单链抗体文库的制备
单链抗体文库的制备基于噬菌体展示技术,将scFv抗体序列插入到噬菌体载体中,进而展示在噬菌体表面。为了获得靶标的单链抗体文库序列,首先我么们需要将靶标作为免疫原进行动物免疫,免疫达到所需效价后采集全血并分离其中的淋巴细胞(PBMC)提取细胞中的RNA,逆转录成cDNA,经PCR扩增得到VH及VL序列,将两者用Linker进行连接并克隆到噬菌体载体中得到重组质粒,将重组质粒转染到大肠杆菌进行噬菌体包装得到噬菌体抗体文库,用于后续文库的筛选。
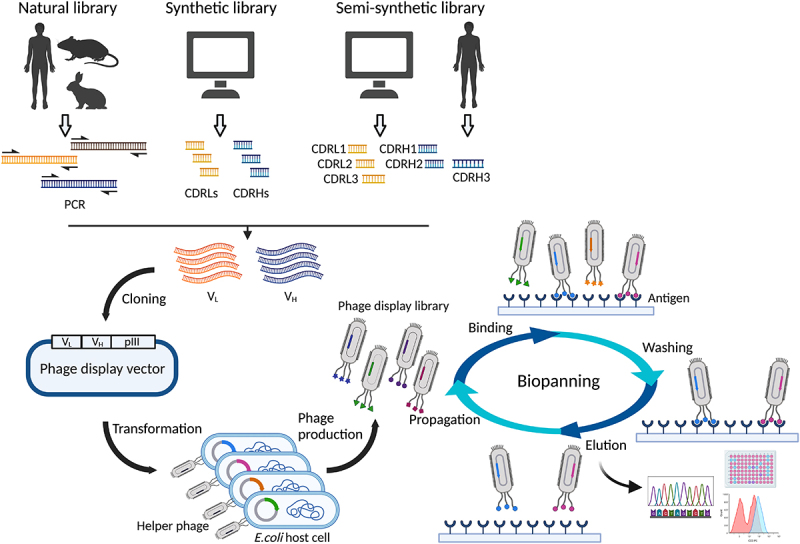
图2 噬菌体文库制备及筛选流程(文献[1])
1. 免疫原的制备:我们需要制备出免疫原性好的靶标分子作为免疫原,免疫原的质量是得到优质抗体的关键,针对较难表达的免疫原蛋白,我们还可以制备腺病毒或腺相关病毒进行动物免疫;还可以提供mRNA包封LNP服务用作免疫原,此种方式可以实现蛋白体内表达并产生免疫反应,免去了蛋白体外表达的步骤,节约了研发成本及时间成本。
2. 动物免疫:选择身体状态良好,免疫背景清楚的免疫动物进行免疫,免疫前需采取血清作为阴性对照,免疫方式为背部分散多点免疫,如果是病毒免疫需要进行肌肉注射,每两周进行一次。
3. PBMC分离:将免疫后的羊驼血清进行效价检测,检测合格后会抽取120ml的羊驼全血,用淋巴细胞分离液进行PBMC的分离。
4. RNA提取及cDNA文库制备:用无酶RNA提取试剂盒提取PBMC中的RNA,反转录成cDNA,再经PCR多轮扩增得到VH及VL序列。
5. 噬菌体文库构建:单链抗体文库构建基于噬菌体展示技术(尤其是M13噬菌体展示技术),通过同源重组的方式将扩增的VH片段与VL片段通过scFv连接肽相连并克隆到噬菌体载体上,使得scFv抗体展示在噬菌体表面。免疫文库库容高达10^9-10^10,文库多样性>90%、插入率95%、阳性率>95%,当然scFv文库的序列也可以从天然或合成文库中获得,只不过相较于免疫文库,天然库和合成文库筛选到与靶标结合抗体的概率比较低,类似于“撞大运”,且其亲和力与特异性也是不能保证的。
6. 噬菌体文库筛选:文库筛选的方式有很多,大体分为固相、液相。固相筛选是将靶标固定到一个载体上(ELISA板或芯片)然后结合文库中的噬菌体;磁珠筛选属于液相筛选的一种,通常将靶标蛋白结合到磁珠上再与文库进行孵育;细胞筛选既可以用固相筛选的方式也可以用液相筛选的方式进行,与其他筛选方式的区别在于筛选源变为了细胞。先进行负向筛选再进行正向筛选为一轮,通常3-4轮就可以得到亲和力强且针对靶标分子的抗体序列,此噬菌体展示的序列组成了靶标分子的高特异性及亲和力的scFv抗体文库,后续此序列可以根据客户的实验需要进行抗体表达及改造。
7. scFv抗体表达:根据下游实验的需要可以对抗体进行个性化定制,比如各种种属来源的IgG表达、各种种属的scFv抗体表达等。
卡梅德生物可为客户提供各种种属的scFv抗体文库构建服务,比如驼源、鼠源、兔源、牛源、猪源等,根据客户的需求进行合理的方案设计和个性化定制,为客户的科研项目及药物抗体开发助力。同时我们还提供从抗原表达到后续抗体成药性检测等上下游服务。
参考文献
[1] Zhang Y. Evolution of phage display libraries for therapeutic antibody discovery. MAbs. 2023 Jan-Dec;15(1):2213793.
[2] Ledsgaard L, Kilstrup M, Karatt-Vellatt A, McCafferty J, Laustsen AH. Basics of Antibody Phage Display Technology. Toxins (Basel). 2018 Jun 9;10(6):236.
[3] Saw PE, Song EW. Phage display screening of therapeutic peptide for cancer targeting and therapy. Protein Cell. 2019 Nov;10(11):787-807.
常见问题解答
Q1:什么是scFv抗体?
A1:scFv抗体,中文全称是单链可变区片段,它是一种通过基因工程改造得到的小分子抗体。scFv由一个抗体的重链可变区和一个轻链可变区通过一条人工设计的短肽连接链连接而成。可变区是抗体的“指纹识别”区域,决定了抗体能特异性地结合哪种抗原;连接肽是一条柔性的氨基酸短链(最常用的是(GGGGS)₃),它的作用就像一根绳子,把VH和VL拴在一起,帮助它们形成正确的三维结构,从而行使功能。
Q2:scFv抗体linker的选用原则?
A2:(1)刚柔性问题:柔性linker,例如(GGGGS)ₙ,甘氨酸(G)分子量最小,侧链仅为一个氢原子,提供了极佳的灵活性;丝氨酸(S)则能增强溶解性,并对抗蛋白酶降解。此linker较长且柔软,在复性时能够降低融合蛋白的两组份间的空间位阻,从而更有利于融合蛋白各个结构域的正确折叠。刚性Linker通常包含丙氨酸(A)、谷氨酸(E)、赖氨酸(K)等,如 (EAAAK)ₙ 序列,可形成稳定的α-螺旋结构,这类linker适用于需要固定两个蛋白结构域相对位置的场景。
(2)Linker长度决定scFv的价态:长约15-20个氨基酸通常用于形成单价scFv单体;缩短至约3-12个氨基酸会促使形成二聚体(Diabodies);进一步缩短至0-2个氨基酸可能形成三聚体(Tribodies) 等更高价态多聚体。
(3)减少相互影响:Linker需要有足够的长度和灵活性,以避免VH和VL两个结构域在折叠时相互空间位阻,确保它们能形成正确的抗原结合口袋。
(4)根据功能需求选择:需要简单单价结合时选择标准长度的柔性Linker(如(GGGGS)₃);追求更高亲和力/多价结合时可考虑缩短Linker以构建多聚体(如Diabodies);若scFv后续需与其他蛋白(如毒素、细胞因子)融合,Linker设计需兼顾两端蛋白的折叠与活性。
Q3:如何从cDNA中获得scFv序列?
A3:(1)引物设计——核心关键
抗体的可变区基因具有高度的多样性,但其骨架区相对保守。我们无法为每一个特定的可变区序列设计一对特异性引物,因此需要使用简并引物——即一套能够覆盖绝大多数可变区基因家族的引物混合物。
靶点位置:VH基因:上游(正向)引物位于前导肽序列或VH基因的5‘端,下游(反向)引物位于恒定区(CH1)或JH基因段。
VL基因:上游引物位于前导肽序列或VL基因的5’端,下游引物位于恒定区(CL)或JL基因段。
简并性:为了匹配不同种系基因的微小差异,引物序列中的某些位置会设计成混合碱基(例如,R = A/G; Y = C/T; S = G/C; N = A/G/C/T)。
引入酶切位点:为了后续克隆到载体中,需要在引物的5‘端加入特定的限制性内切酶位点(如 Sfi I, Not I, Xho I, Nco I 等)。这些位点在cDNA模板中不存在,因此不会被切割。
(2)PCR扩增
使用高保真DNA聚合酶(如Phusion, KOD等)进行PCR,以减少扩增过程中引入的突变。分别设置VH和VL的PCR反应体系。通过琼脂糖凝胶电泳验证扩增产物的大小是否正确(VH和VL片段通常都在~400 bp左右),并回收纯化目的条带。
(3)通过重叠延伸PCR(SOE-PCR)组装scFv基因
第一步PCR(重叠延伸):将纯化的VH和VL片段按一定比例混合,在不加外侧引物的情况下进行几轮PCR。此时,VH和VL会通过互补的Linker序列退火并相互延伸,形成全长的scFv序列。
第二步PCR(富集放大):然后加入针对scFv基因最外侧两端的引物,进行大量扩增,得到丰富的scFv基因产物。
最终产物:一个完整的scFv基因,结构为 VH - Linker - VL(或 VL - Linker - VH)。
Q4:scFv抗体主要的应用领域有哪些?
A4:(1)靶向治疗与药物递送:将scFv与毒素、放射性同位素或药物连接,制成“生物导弹”,精准攻击肿瘤细胞;
(2)CAR-T细胞疗法:scFv是构成CAR(嵌合抗原受体)的抗原结合域的核心部分,负责识别肿瘤细胞表面的特定靶标;
(3)分子影像诊断:用放射性核素标记scFv,通过PET/CT等成像技术,实现病灶的精准定位;
(4)基础研究工具:作为细胞内抗体,在细胞内部中和特定蛋白的功能,用于研究基因功能。
Q5:如何鉴定文库的多样性及插入率?
A5:将抗体片段与载体进行同源重组后转化到大肠杆菌中,从转化菌板中挑取24-48个单克隆,进行PCR鉴定,如果在与载体连接时引入的是酶切位点则在鉴定时还可以采用酶切鉴定的方式进行插入率鉴定。多样性检测需要在菌板上随机挑取多个单克隆并对它们进行序列测序,把测序结果中的scFv序列截取出来进行比对,查看非重复序列的比例,此比例可代表多样性占比。
- 单链抗体
- scFv
- 噬菌体文库构建
- 文库筛选
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





