Cas9-EDV:实现精准体内细胞编辑的创新平台
- 2025-11-10
- 240
CRISPR-Cas9技术依托其高效性与灵活性如今已成为基因功能研究、疾病模型构建及创新疗法开发的核心工具。但是如何把编辑工具以安全、高效且兼具特异性的方式递送至目标细胞内,尤其是在活体内实现细胞的选择性编辑,始终是制约该技术临床转化的瓶颈。
近年来,科研人员结合病毒递送系统的高效性与抗体识别的精准性开发出新一代包膜递送载体,为基因编辑技术的临床应用开辟了全新路径。
2024年Jennifer R. Hamilton在《Nature Biotechnology》发表一项研究,提出名为“Cas9-EDV”的新型系统,该系统首次在活体内完成人类T细胞的精准编辑操作,体现出出色的靶向能力与安全性,为基因编辑领域未来的发展指明了前进方向。

图1 文章摘要
一、基因编辑的核心挑战
传统基因编辑技术如CRISPR-Cas9,虽然在体外实验中表现优异,但在体内应用中仍面临两大核心挑战:
1. 递送效率不足:非病毒方式(如电穿孔)难以用于系统性给药,且对等原代细胞的编辑效率低;
2. 缺乏细胞选择性:病毒载体(如AAV、慢病毒)虽然可以达成高效递送,但其天然趋向性限制了靶向范围,且可能引发免疫反应或导致转基因的随机整合。
这些局限性推动业界急需研发一种可将基因编辑工具靶向递送到特定细胞种类的技术载体。Hamilton团队的研究恰好围绕该需求推出了具备可编程特性的Cas9-包膜递送系统(Cas9-EDV系统)。
二、Cas9-EDV载体的技术优势
Cas9-EDV系统的设计思路创新性十足,其精妙融合了慢病毒样颗粒的封装能力与抗体片段的特异识别能力:
● 精准靶向分子呈现:在颗粒表面共同表达单链抗体片段与突变亚型VSVG糖蛋白,前者承担细胞表面抗原(如CD3、CD19、CD28等)的识别任务,后者引导内体逃逸过程,保障内部物质高效释放。
● 预组装Cas9 RNP递送:颗粒内部包裹的是提前组装完成的Cas9蛋白与sgRNA复合物,而非DNA编码序列。该策略不仅规避了基因组整合风险,还压缩了编辑窗口,大幅减少了脱靶编辑的概率。
● 模块化及可编程架构:研究人员借助替换各类scFv靶向模块,顺利达成了对CD4+T细胞、CD8+T细胞、B细胞等多种免疫细胞亚群的特异性编辑,证实了该平台的细胞选择性及通用性。
这项研究表明,在混合细胞群体内,CD19靶向的Cas9-EDV在CD19+细胞中B2M基因敲除率高达74%,在非目标细胞中编辑效率不足2%,体现出出色的细胞特异性。此外,该系统于静息T细胞中同样可有效引导编辑过程,打破了传统电穿孔技术对细胞预激活的需求限制。
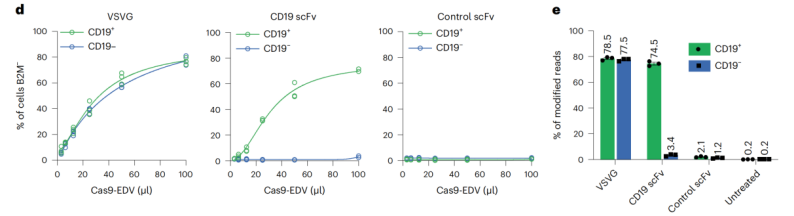
图2 利用抗体靶向Cas9-EDV进行细胞特异性基因组编辑
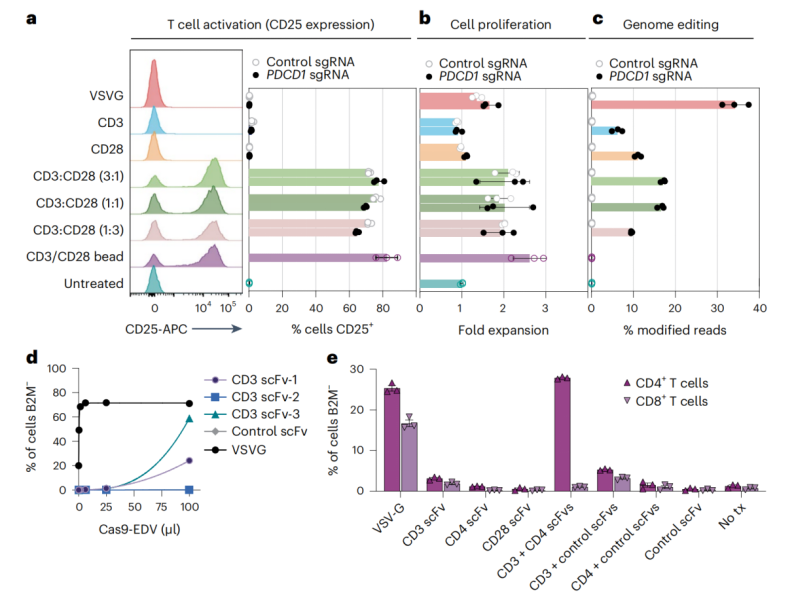
图3 针对原代人类T细胞的多重抗体靶向及编辑技术
三、体内细胞工程的重大突破
传统CAR-T细胞治疗法需从患者体内提取T细胞,于体外开展基因修饰与扩增后,重新输回患者体内,全过程需耗时数周,且成本偏高,并且存在着明显个体差异。Cas9-EDV系统的突破点在于首次达成体内编辑与CAR-T细胞的同步产生。
研究人员在人工免疫系统重建的小鼠模型里,借助单次系统性注射靶向T细胞的Cas9-EDV(同时展示CD3、CD4与CD28scFv),成功在脾脏内检测到表达CD19-CAR的T细胞,且同步实现了T细胞受体TRAC位点的特异性编辑。这类“体内出厂”的CAR-T细胞不仅拥有多样化的克隆来源,还可有效清除CD19+B细胞,呈现出完整的功能活性。
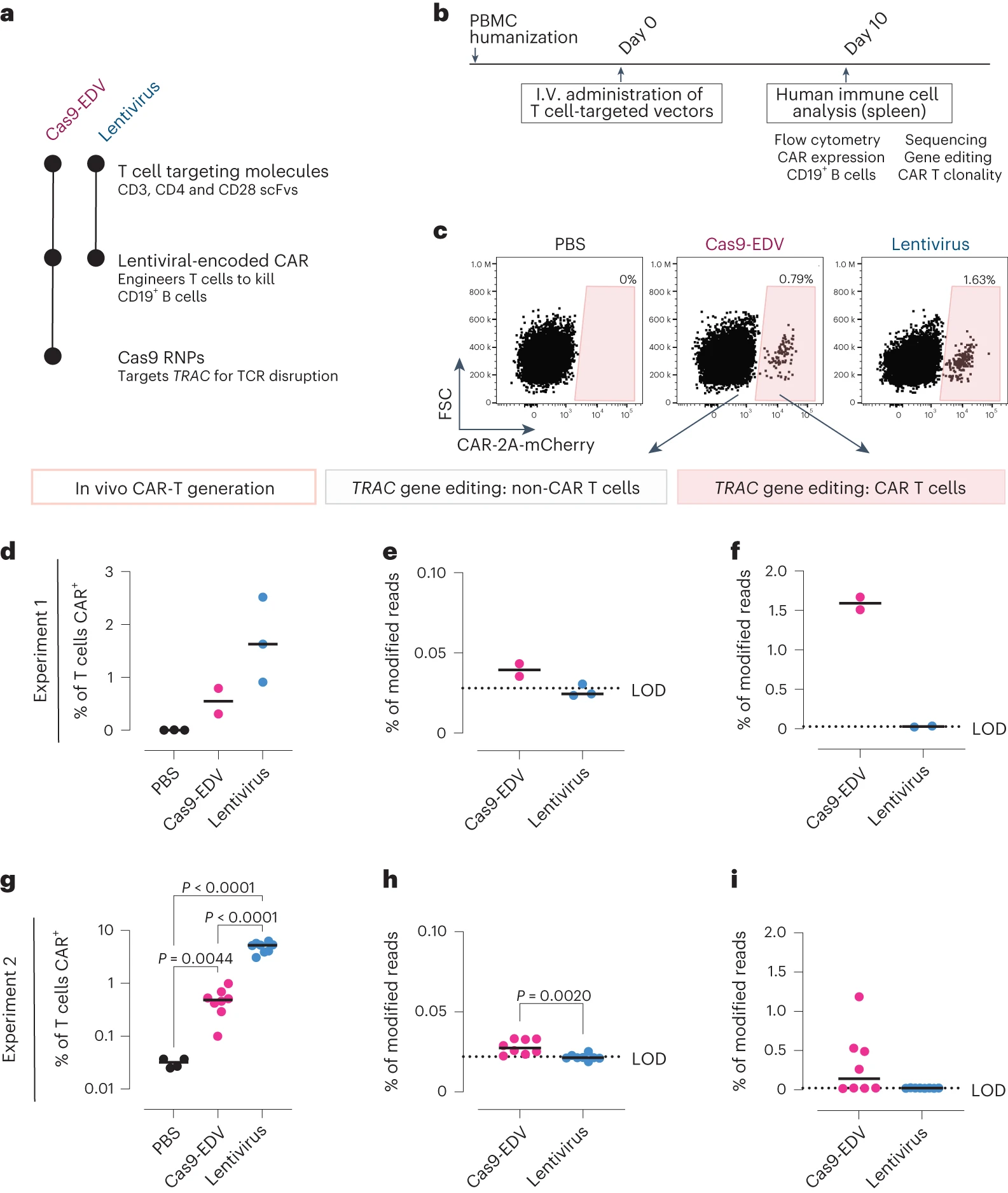
图4 可编程的人类细胞递送在体内产生基因编辑的CAR-T细胞
研究结果表明,经编辑的CAR-T细胞的编辑效率明显高于非CAR-T细胞的TRAC位点编辑效率(1.67% vs 0.04%),证实Cas9-EDV在递送CAR转基因过程中,可优先在目标细胞内实现基因编辑。该成果意味着基因编辑技术已从“体外改造”阶段正式迈向“体内编辑”的全新阶段,为未来即时治疗开展奠定稳固技术根基。
四、技术优势与行业应用前景
Cas9-EDV平台具备以下几大核心优势,使其在基因编辑服务领域极具竞争力:
● 卓越的靶向性与安全性:通过精确的抗体抗原相互作用来实现细胞的特异性识别,研究中特别强调了未检测到肝细胞编辑,有效避免了传统递送系统的肝脏富集问题;
● 瞬时编辑与低免疫原性:递送的是预组装蛋白-RNA复合物,非病毒基因组,大幅降低长期表达风险和免疫原性;
● 多功能载荷能力:可同时递送基因编辑工具与转基因,支持复杂的多重细胞工程;
● 无需细胞预激活:在递送过程中通过CD3/CD28 scFv共展示即可激活T细胞,极大简化治疗流程;
● 可扩展的平台技术:该平台不仅限于T细胞编辑,研究者已证明其对CD34+造血干细胞等多种原代细胞的有效性,展现出广泛的适用性。
这些特性使得Cas9-EDV成为了实现靶向递送的理想平台,适用于如肿瘤免疫治疗、自身免疫疾病干预、遗传病纠正等需要高精度细胞工程的应用领域。
基因编辑技术正由“工具研发”阶段加速进入“临床应用”阶段。以Cas9-EDV为典型的创新性靶向递送系统攻克了体内编辑的靶向困境并大幅拓宽了基因编辑的应用范围。卡梅德生物将不断投入细胞选择性编辑平台的优化及标准化,打造为客户供给从靶点验证、载体设计、效率优化到体内药效评估的全流程基因编辑解决方案。
参考文献
[1] Hamilton JR, Chen E, Perez BS, Sandoval Espinoza CR, Kang MH, Trinidad M, Ngo W, Doudna JA. In vivo human T cell engineering with enveloped delivery vehicles. Nat Biotechnol. 2024 Nov;42(11):1684-1692.
常见问题解答
Q1:病毒载体与非病毒载体在基因编辑递送中的优劣比较
A1:1. 病毒载体(如慢病毒、腺相关病毒):
(1)优势:天然的高转导效率、可感染非分裂细胞、部分具有组织趋向性。
(2)劣势:可能整合至基因组(如慢病毒)、包装容量有限、免疫原性强、生产成本高。
2. 非病毒载体(如LNP、电穿孔、聚合物纳米颗粒):
(1)优势:较低的免疫原性、无基因组整合风险、易于规模化生产。
(2) 劣势:体内递送效率低、缺乏细胞特异性、对原代细胞(如静息T细胞)编辑效果差。
目前趋势是开发杂交系统,如病毒样颗粒或仿生纳米颗粒,以结合两者优点。
Q2:什么是“体内编辑”(in vivo editing)?它与体外编辑有何根本区别?
A2:“体内编辑”指直接在生物体内对目标细胞进行基因编辑,而“体外编辑”则需先将细胞取出,编辑后再回输。两者区别如下:
(1)操作流程:体内编辑简化了治疗路径,避免细胞采集、扩增和回输等复杂步骤,尤其适用于难以体外培养的细胞类型。
(2)选择性:体内编辑依赖递送系统的靶向能力,对载体设计提出更高要求。
(3)安全性:体外编辑可进行严格的质量控制;体内编辑则需考虑全身给药后的分布、清除和潜在免疫反应。
(4)适用场景:体内编辑更适合系统性疾病(如遗传病、弥漫性肿瘤),而体外编辑目前主要用于局部或可提取的细胞(如CAR-T)。
Q3:如何评估基因编辑技术的“特异性”与“脱靶风险”?
A3:(1)全基因组测序:通过WGS识别非预期突变。
(2)细胞系筛选模型:如利用REPAIR或GOTI等方法在单细胞水平评估编辑准确性。
(3)计算预测工具:如Cas-OFFinder、CCTop等基于序列相似性预测潜在脱靶位点。
(4)功能验证:在混合细胞群体中比较目标与非目标细胞的编辑效率,并通过功能性读值(如蛋白表达)确认编辑效果。
此外,新型编辑器(如高保真Cas9、碱基编辑器)和递送策略(如瞬态RNP递送)可显著降低脱靶风险。
Q4:基因编辑是否可能引发免疫反应?如何应对?
A4:基因编辑可能通过以下机制引发免疫反应:
(1)外源蛋白免疫原性:如细菌来源的Cas蛋白被宿主免疫系统识别。
(2)载体相关免疫:病毒载体或脂质颗粒可能激活先天或适应性免疫。
(3)编辑后新抗原:非同源末端连接修复可能产生新表位。
应对策略包括:
(1)使用人源化或低免疫原性编辑器;
(2)采用非病毒或瞬态递送系统;
(3)联合免疫抑制剂或使用“隐形”载体;
(4)在免疫豁免组织或局部给药中优先应用。
Q5:基因编辑在免疫细胞治疗中的应用前景如何?
A5:免疫细胞(特别是T细胞、NK细胞)是基因编辑的理想对象,其应用前景包括:
(1)增强抗肿瘤功能:通过敲除免疫检查点(如PD-1)、引入激活受体(如CAR)或编辑信号通路(如TCR)提升细胞毒性。
(2)降低免疫排斥:敲除HLA基因构建通用型CAR-T,实现“off-the-shelf”治疗。
(3)调控细胞命运:编辑记忆T细胞或调节性T细胞以增强持久性或抑制自身免疫。
未来挑战在于如何在体内高效、安全地编辑免疫细胞,并控制其增殖与分化行为。
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





