浅谈VHH抗体的发现
- 2025-09-05
- 271
1. 纳米抗体的发现
20世纪80年代末期,比利时布鲁塞尔自由大学的Raymond Hamers-Casterman课题组在分析骆驼血清免疫球蛋白时,观察到一个有趣的现象:骆驼体内的部分抗体仅由两条重链同源二聚体构成,而当时公认的哺乳动物抗体结构均是由两条轻链和两条重链构成的。这个新的发现使得团队成员对该抗体开启了深度地探究。经多年研究,他们最终确认,这种抗体广泛存在于骆驼科物种中,其与抗原结合的功能完全依赖于其重链的可变区——该结构域于1993年被正式命名为VHH。
2. 纳米抗体的命名
VHH本质上是一个单结构域的抗体片段,大小只有约12-15 kDa,只有传统抗体的三分之一,然而,尽管VHH体积小且没有轻链,它却与常规抗体一样,拥有亲和力高和特异性强的特点,此外,它还具有稳定性高、溶解性好和组织穿透能力强等优点。基于VHH的这些卓越的特性,科学家们利用基因工程技术,从免疫过的骆驼科动物中克隆VHH基因,针对特定的靶点进行重组VHH抗体制备,并将这种新发现的抗体命名为纳米抗体。
3. 纳米抗体制备来源
在骆驼科动物免疫系统的研究中,羊驼因其独特的生物学特性成为VHH抗体制备的理想模型。羊驼体积小、性格温顺,大大降低了饲养和实验的难度,其血液样本易获取,单次采血便可进行大规模抗体库构建。此外,羊驼免疫系统存在高比例重链抗体,占血清抗体的25-75%;对于VHH的免疫响应强,纳米抗体表达程度较高,因此研究人员多以免疫羊驼作为VHH抗体制备的主要方式。
4. 噬菌体展示筛选
当科学家从免疫羊驼体内获得数十亿个VHH基因片段后,如何对这些片段进行筛选是科学家面临的第一大难题。传统的杂交瘤技术依赖B淋巴细胞与骨髓瘤细胞的融合。但分泌VHH的B细胞本身不表达轻链基因,强行融合会导致细胞因蛋白折叠错误而凋亡。而噬菌体展示可以跳过细胞融合的步骤,将VHH 基因克隆到噬菌体载体中,使VHH展示在噬菌体颗粒表面,形成噬菌体展示文库,进而直接对VHH基因进行筛选与富集,成为了连接免疫羊驼与纳米抗体表达的核心桥梁。
5. 纳米抗体表达
将筛选获得的VHH基因转化为功能性纳米抗体蛋白,其表达系统的选择需兼顾蛋白活性、生产成本及规模化需求。VHH凭借其单域结构与独特折叠特性,在多种表达系统中均能高效形成天然构象,可以根据不同人群的不同需求进行低成本、大规模的生产。为了降低其免疫原性,提高其对抗原的亲和力,科学家们不断地找寻并优化改造方法,最终实现了对VHH抗体进行人源化改造。通过将人源免疫球蛋白重链基因簇整合至Ig基因敲除小鼠模型,经抗原免疫刺激后,该工程化小鼠便可分泌仅含重链的功能性抗体,以提高抗体治疗效果。
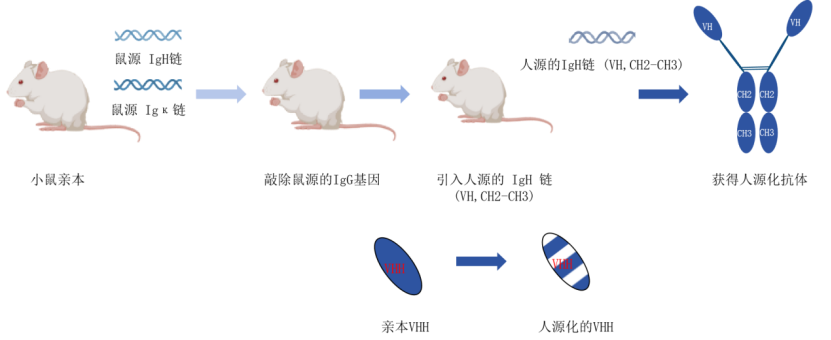
图1 VHH抗体人源化服务流程(VHH抗体人源化服务_天津卡梅德科技发展有限公司)
卡梅德生物将成熟的噬菌体展示与筛选技术与抗体表达及纯化平台相结合,可在短时间内制备出大量客户需要的VHH抗体。截止目前,我们已经制备出大量针对细胞因子、细胞表面受体、肿瘤抗原、病毒、细菌、酶和毒素等不同靶点的高亲和力和特异性VHH抗体。此外,我们建立了完善的纳米抗体制备体系,拥有多个适合抗体表达的体系,提供VHH抗体人源化服务,满足您多方面的需求。
[1] Muyldermans S. Single domain camel antibodies: current status. J. Biotechnol. 2001 Jun;74(4):277-302.
[2] Goldman ER, Anderson GP, Zabetakis D, et al. Llama-derived single domain antibodies specific for Abrus agglutinin. Toxins (Basel). 2011 Nov;3(11):1405-19.
[3] Jones ML, Alfaleh MA, Kumble S, et al. Targeting membrane proteins for antibody discovery using phage display. Sci. Rep. 2016 May 18;6:26240.
Q1:纳米抗体为什么比普通抗体“小”?小有什么好处?
A1:纳米抗体的分子量仅为12-15 kDa,约传统IgG抗体的1/3。这种微小尺寸赋予纳米抗体三大核心优势:
1.组织穿透性:可高效渗透实体瘤屏障或穿越血脑内皮;
2. 结合精准性:CDR3区独特构象增强表位识别能力,对病毒/癌细胞表面靶点亲和力提升3-5倍;
3. 化学稳定性:耐受室温长期储存,显著优于依赖冷链的传统抗体。
Q2: 纳米抗体相较于传统IgG抗体在分子稳定性上有哪些结构性优势?
A2:纳米抗体(VHH)相较于传统IgG抗体的稳定性优势本质源于其单域结构特征。由于完全缺失轻链,VHH通过单域折叠形成高度致密的疏水核心区,赋予其卓越的化学稳定性,可耐受60–80°C高温及极端pH环境。而传统IgG通常在40–50°C即发生不可逆变。同时,轻链的缺失彻底消除了轻重链错配的风险,显著降低高浓度下的聚合倾向,维持优异的可溶性。此外,其框架区FR2的特异性亲水突变有效增强抗蛋白酶解能力,使其在胃肠道或组织蛋白酶富集等严苛生物环境中保持功能完整性。
Q3:什么是噬菌体展示系统?
A3:噬菌体展示系统是一种将外源蛋白或多肽基因插入噬菌体衣壳蛋白编码基因中,使目标蛋白表达并展示于噬菌体颗粒表面的分子展示技术。其核心原理基于基因型与表型的物理偶联:通过基因工程将抗体片段、肽段或蛋白结构域文库插入噬菌体基因组(常用pIII或pVIII基因),经宿主表达后,外源蛋白将折叠为天然构象并嵌入噬菌体外膜,形成“噬菌体-蛋白”融合颗粒;利用靶分子(如抗原、受体)对展示库进行固相或液相筛选,结合力强的噬菌体被特异性富集,回收的噬菌体可感染宿主菌扩增,最终通过基因测序解码高亲和力蛋白序列。该系统实现了从数十亿分子中高效筛选功能性生物配体,成为抗体工程与药物开发的基石平台。
Q4:纳米抗体生产为何比传统杂交瘤技术更具效率和成本优势?
A4:纳米抗体生产相较于传统杂交瘤技术的效率与成本优势核心体现在全链条优化: 其制备路径以羊驼免疫为起点,结合噬菌体展示文库筛选,彻底规避了杂交瘤技术中因VHH缺乏轻链导致的B细胞融合凋亡难题;在表达阶段,VHH单域结构无需糖基化修饰,可直接通过大肠杆菌或酵母系统实现高效重组表达,而杂交瘤依赖哺乳动物细胞培养,成本高昂且产量较低。
环节 | 传统杂交瘤技术 | 纳米抗体制备 |
动物免疫 | 小鼠/大鼠 (6–12个月) | 羊驼 (8–12周,高重链抗体比例) |
筛选平台 | 细胞融合 (成功率<30%) | 噬菌体展示 (文库筛选效率>90%) |
生产系统 | 哺乳动物细胞 (高成本、低产量) | 大肠杆菌/酵母 (低成本、高表达) |
- VHH抗体制备
- 纳米抗体表达
- 噬菌体展示筛选
- 抗体人源化
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





