TCR-T治疗和应用前景介绍
- 2025-09-13
- 190
一、背景介绍
TCR是主要负责特异性识别和介导免疫应答的两条高度可变的异质肽链组成的T细胞表面分子。TCR包括α、β、γ和δ四条肽链,其中α和β肽链形成αβ TCR,而γ和δ肽链形成γδ TCR。αβTCR通过结合肿瘤细胞或抗原递细胞(APC)上的组织相容性复合体(MHC)来激活TCR信号通路,以及介导T细胞免疫功能的一系列细胞内蛋白,包括70-KDZETA相关蛋白(ZAP70)和激活T细胞核因子2(NFAT2)。基于免疫细胞能够识别并消灭癌细胞的理论,目前正在改变癌症治疗理念的免疫疗法。
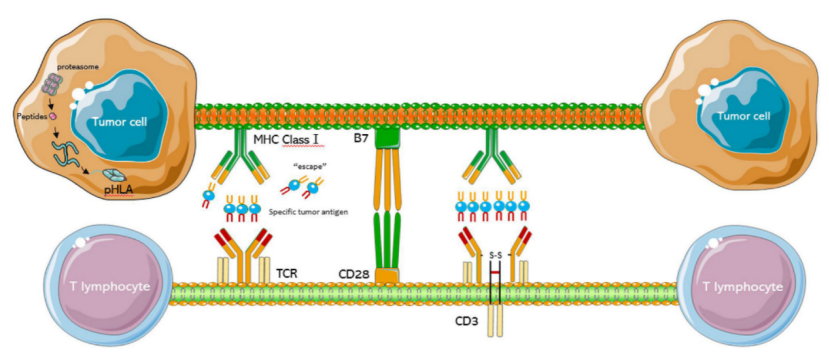
TCR-T细胞结构示意图
二、TCR-T细胞治疗的发展过程
近5年来TCR-T技术连续经历了4个代的更新,集中解决了生产问题和疗效的难题,TCR-TR技术一直处于前沿。第一代从患者本身采集肿瘤抗原特异性T细胞亚群,经过离体扩增后,然后回输给患者本身,由于TCR-T细胞克隆个体差异很大,工业化生产很难做到;第二代将第一代TCR-TR细胞的TCR基因序列,用基因工程技术克隆出来,转移到患者周围的血液中,就可以进行大规模的生产;第三代以增强肿瘤亲和力的目的来改善TCR-T细胞疗法的治疗效果;第四代TCR-T细胞疗法具有较高特异性,通过靶向新抗原使得肿瘤反应及安全性更好。
三、靶抗原的选择
人的肿瘤抗原主要分为肿瘤特异性抗原和肿瘤相关抗原,其中肿瘤特异性抗原包括新抗原和病毒抗原,肿瘤相关抗原可分为癌/睾丸(CT)抗原、过表达抗原和分化抗原等。为了限制任何潜在的脱靶效应,我们通常选择在肿瘤中表达水平较低的靶抗原,而这种靶抗原在正常组织中表达程度较低。对于正常组织破坏造成的剂量限制性毒性,选择该靶抗原也可以降低。目前,在大多数TCR-T细胞治疗中,最常用的靶抗原就是CT抗原和病毒抗原。
四、TCR亲和力筛选
目前TCR只能识别肽-HLA,并对与HLA等位元基因相匹配的癌细胞进行杀灭。为此,筛选更合适的HLA匹配对于我们来说是非常有必要的。我们通过鉴定出对抗原具有高亲和力的TCR来增强免疫应答。其中基因工程T细胞的抗肿瘤活性一般是通过转化过程来增强其亲和力的。当TCR亲和性超出生理功能时会对T细胞造成损伤,我们需要将亲和力控制在一定范围内。然而,太低的亲和力可能对靶向的非肿瘤组织有毒性,亲和力过高可能会导致免疫异常激活,增加触发细胞因子风暴的风险。因此,筛选具有最佳亲和力阈值的TCR是开发安全有效的T细胞疗法的关键一步。
五、TCR-T细胞治疗应用前景
TCR-T细胞可以识别内源性蛋白或者多种肿瘤相关抗原,克服了抗体药物和CAR-T疗法无法针对的缺点,在实体瘤上迈出了坚实的第一步。此外,通过TCR高通量筛选鉴定、TCR亲和力优化、控制TCR安全性等技术创新不断对TCR-T进行改造升级以实现对肺癌、卵巢癌、消化道肿瘤等其他肿瘤的突破;然而由于实体瘤免疫抑制微环境及脱靶毒性等问题的存在,TCR-T仍存在较多的问题尚待解决,但我们相信TCR-T作为一种精确靶向且具有优越效力的技术手段必将在临床上发挥重要作用。
卡梅德生物以成熟单细胞筛选以及噬菌体展示技术为基础,通过定向进化的技术手段,从上百万亿的T细胞库里面筛选出优秀的T细胞受体序列,对该序列进行进一步改造后,达到对实体瘤靶点具有特异性的TCR识别,解决了天然TCR亲和力差的技术问题,极大提高了TCR亲和力至pM级。我们利用“靶点-TCR-工艺”全流程技术闭环的优势,为客户提供高质量的CRO服务!
[1] Baulu E, Gardet C, Chuvin N, Depil S. TCR-engineered T cell therapy in solid tumors: State of the art and perspectives. Sci Adv. 2023; 9(7): eadf3700.
[2] Liu Y, Yan X, Zhang F, et al. TCR-T Immunotherapy: The Challenges and Solutions. Front Oncol. 2022; 11: 794183.
[3] Hiltensperger M, Krackhardt AM. Current and future concepts for the generation and application of genetically engineered CAR-T and TCR-T cells. Front Immunol. 2023; 14: 1121030.
常见问题解答
Q1:什么是TCR-T细胞疗法?
A1:采用高通量单细胞测序技术,从患者或模型动物的T细胞中筛选出具有高亲和力、高特异性的T细胞受体(TCR)序列,这种免疫治疗方法被称为TCR-T细胞疗法。TCR-T细胞疗法的关键就是从病人或者实验动物的淋巴细胞群中找到能与抗原紧密结合的TCR分子,将分离出来的抗原特异性T细胞进行 α链、β链配对测序,结合生物信息学分析方法可以鉴定出针对目标抗原的优势克隆。
TCR-T细胞疗法突破了传统克隆筛选的技术瓶颈,通过筛选获得完整的αβ链配对信息,得到正确折叠后的受体蛋白,可以将相应序列直接用于构建病毒载体,建立系统性的免疫受体数据库,为未来疾病治疗提供更多的候选序列。
Q2:TCR-T序列的结构包括哪些?
A2:TCR-T序列的核心结构是编码人工改造的T细胞受体的基因序列。它主要包括两个关键部分:一是TCR的α链基因序列,二是TCR的β链基因序列(少数情况下可能是γδ链)。每条链的基因序列都包含决定抗原特异性的可变区(V区)和提供结构稳定性的恒定区(C区)。其中可变区内的三个互补决定区(CDR1、CDR2、CDR3)最为重要,尤其是CDR3环,它直接负责识别并结合由主要组织相容性复合体(MHC)呈递的特定肿瘤抗原肽段。整个序列通常还整合了必要的调控元件、信号肽序列、跨膜区以及可能的胞内信号增强结构域,确保外源TCR能在患者T细胞表面稳定表达并有效传递激活信号。
Q3:如何设计针对某一种疾病的特定TCR-T序列?
A3:设计针对特定疾病的TCR-T序列的核心目标是获得能精准识别疾病相关抗原的高亲和力、高特异性TCR基因序列,其关键步骤包括:
首先确定靶抗原,通常选择在病变细胞上特异性高表达、功能重要的抗原。其次是分离天然TCR,通过从患者或健康供体的抗原特异性T细胞中克隆天然TCR基因,或利用噬菌体展示/酵母展示库筛选高亲和力TCR。随后进行TCR基因工程改造,对抗原结合关键区域(尤其是CDR3环)进行优化,通过体外突变和亲和力成熟增强TCR对pMHC的结合力与特异性,同时需严格评估脱靶风险。此外,还需匹配患者HLA分型(确保MHC限制性)并优化序列结构。然后构建基因载体,将优化后的TCR α/β链基因序列与调控元件(启动子、信号肽、跨膜区)整合至病毒载体,最终转导患者T细胞,经体外扩增和功能验证后回输。整个过程需结合生物信息学预测与严格体外/体内实验验证其安全性和有效性。
Q4:TCR-T细胞疗法的应用有哪些?
A4:TCR-T细胞疗法在肿瘤免疫治疗方面有着极大的优势。它是通过特定引导序列特异性地识别并结合肿瘤细胞上表达的肿瘤相关抗原或者新发抗原来特异性杀伤肿瘤组织。采用BNT221联合白介素2每周给药1-3次,2个半月可将病灶缩小约20%,同时还可以让更多的免疫细胞向肿瘤部位集中。
这项技术本身对病毒相关的癌症存在双重机制。它可以通过重新激活人体内抗病毒的免疫保护系统,使病原体得到有效消灭,在根源上解决慢性病毒感染相关疾病的发生问题,带来治愈癌症新的曙光。
Q5:TCR-T疗法与CAR-T疗法有何本质区别?
A5:如下图所示
名称 | TCR-T | CAR-T |
识别机制 | MHC-肽复合物(胞内/ 表面抗原) | 细胞表面抗原(无需MHC) |
靶点范围 | 广(胞内抗原为主) | 窄(仅表面抗原) |
适用肿瘤 | 实体瘤优势(如肉瘤、胰腺癌) | 血液瘤优势(如白血病、 淋巴瘤) |
抗原敏感性
| 高(低密度抗原有效) | 低(需高抗原密度) |
信号传导 | 持久(多ITAMs,协同CD4⁺/CD8⁺) | 短暂(少ITAMs,易耗竭) |
临床优势 | 实体瘤突破性疗效 | 血液瘤高缓解率,毒性管理成熟 |
- TCR-T 技术
- 亲和力筛选
- TCR-T细胞疗法
- 病毒抗原
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





