PROTAC:靶向蛋白降解,成为“不可成药”靶点的破局者
- 2025-10-09
- 182
蛋白降解靶向嵌合体(PROTAC)技术是近年来颠覆性新药研发领域的核心方向之一。它通过利用人体固有的蛋白降解机制,直接清除致病靶蛋白,为解决传统“不可成药”靶点提供了全新范式。本文将系统介绍PROTAC技术的作用原理、独特优势及当前研发前沿。
一、核心技术原理:事件驱动的靶向降解
PROTAC技术的核心在于利用细胞内的“泛素-蛋白酶体系统”(UPS)。这是一种高度特异性的细胞内蛋白质量控制系统。PROTAC分子作为一种双功能小分子,通过三步机制完成对靶蛋白的清除:
募集靶蛋白:PROTAC分子一端通过一个靶蛋白配体(Warhead)与特定的疾病相关靶蛋白结合。
招募E3泛素连接酶:分子另一端通过一个E3泛素连接酶配体,同时招募一个E3泛素连接酶。
形成三元复合物并降解:PROTAC作为桥梁,促使“靶蛋白-PROTAC-E3连接酶”三元复合物的形成。E3连接酶随后给靶蛋白贴上“泛素”标签,被标记的靶蛋白会被细胞内的蛋白酶体识别并降解。
整个过程是催化性和事件驱动的,一个PROTAC分子可循环使用,高效降解多个靶蛋白分子,因此往往在低剂量(纳摩尔级别)下即可展现优异活性。
二、PROTAC分子的模块化设计
一个典型的PROTAC分子由三个模块化部分构成:
靶蛋白配体:通常来源于已知的靶点抑制剂或激动剂,经过优化以实现高效、特异性结合。
E3连接酶配体:用于招募特定的E3连接酶。目前最常用的是CRBN和VHL的配体,此外MDM2、IAP等也有应用。
连接链(Linker):连接两个配体的化学结构。Linker的长度、组成和刚性对三元复合物的形成效率、降解活性及药物理化性质至关重要。
这种模块化设计赋予了PROTAC技术极高的灵活性和可编程性,为针对不同靶点的快速药物开发提供了可能。
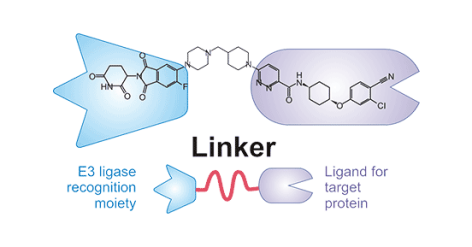
图1 PROTAC分子结构 [3]
三、与传统小分子抑制剂相比的显著优势
| 特征 | 传统小分子抑制剂 | PROTAC降解剂 |
| 作用机制 | 占据活性位点,抑制功能 | 诱导靶蛋白降解,彻底清除 |
| 靶点范围 | 依赖活性位点,限于“可成药”靶点 | 只需结合即可,可靶向“不可成药”靶点 |
| 耐药性 | 易因靶点突变而失效 | 潜在克服耐药性 |
| 作用模式 | 占据驱动,需高浓度持续占据 | 事件驱动,催化模式,低剂量高效 |
| 选择性 | 有时受ATP结合域同源性影响 | 可能通过三元复合物实现更高选择性 |
四、研发前沿与展望
PROTAC技术自概念提出至今已逾20年,发展迅猛。根据PROTAC-DB数据库统计,目前已收录超过1600个PROTAC分子。全球已有多个在研PROTAC药物进入临床开发阶段,展现了该技术的转化潜力。
当前研究前沿集中在:
拓展E3连接酶工具箱:开发新型E3连接酶配体,以扩展组织特异性并减少潜在耐药性。
优化分子性质:通过理性设计(如计算化学、AI辅助)改善PROTAC分子较大的分子量所带来的口服生物利用度等成药性挑战。
拓展疾病领域:除了细胞增殖相关疾病,PROTAC技术在神经退行性疾病、自身免疫病等领域也展现出广阔前景。
[1] Sakamoto, K.M. et al. (2001). Proc Natl Acad Sci U S A.
[2] Cecchini, Carlotta, et al. "Exploring the ubiquitin-proteasome system (UPS) through PROTAC technology." Chimia 74.4 (2020): 274-274.
[3] Pagan, Julia, et al. "Role of the ubiquitin proteasome system in the heart." Circulation research 112.7 (2013): 1046-1058.
[4]Bondeson, D.P. et al. (2018). Cell Chem Biol.
[5]Nalawansha, D.A. & Crews, C.M. (2020). Cell Chem Biol.
[6]Han, X. et al. (2022). Acta Mater Med.
- PROTAC
- 蛋白降解
- 泛素-蛋白酶体系统
- 三元复合物
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





