浅谈中和多克隆抗体发现
- 2025-12-03
- 161
一、中和多克隆抗体的发现背景与特性
在抗体类药物发展进程中,单克隆抗体凭借自身的高特异性已成为治疗性抗体领域的主流类型。但是在面对HIV、流感病毒及 SARS-CoV-2这类高度变异病原体时,仅针对单一表位的靶向方式常会造成病毒逃逸突变,这一局限性推动着科研人员把研究目光重新转向具备多表位识别能力的中和多克隆抗体。
在免疫个体的血清里天然存在着中和多克隆抗体,这类抗体是由多种B细胞分泌产生的,可以同时与病原体表面的多个抗原表位结合,并且依靠协同作用显著提升中和效果,能够有效阻止免疫逃逸现象的发生。中和多克隆抗体的核心优势主要体现在它突出的表位多样性,和仅针对单一抗原决定簇的单克隆抗体不同,多克隆抗体混合物能够覆盖多个区域,包括中和表位、非中和表位以及隐藏表位等不同类型,在生物体内建立更全面、韧性更强的免疫防御体系。
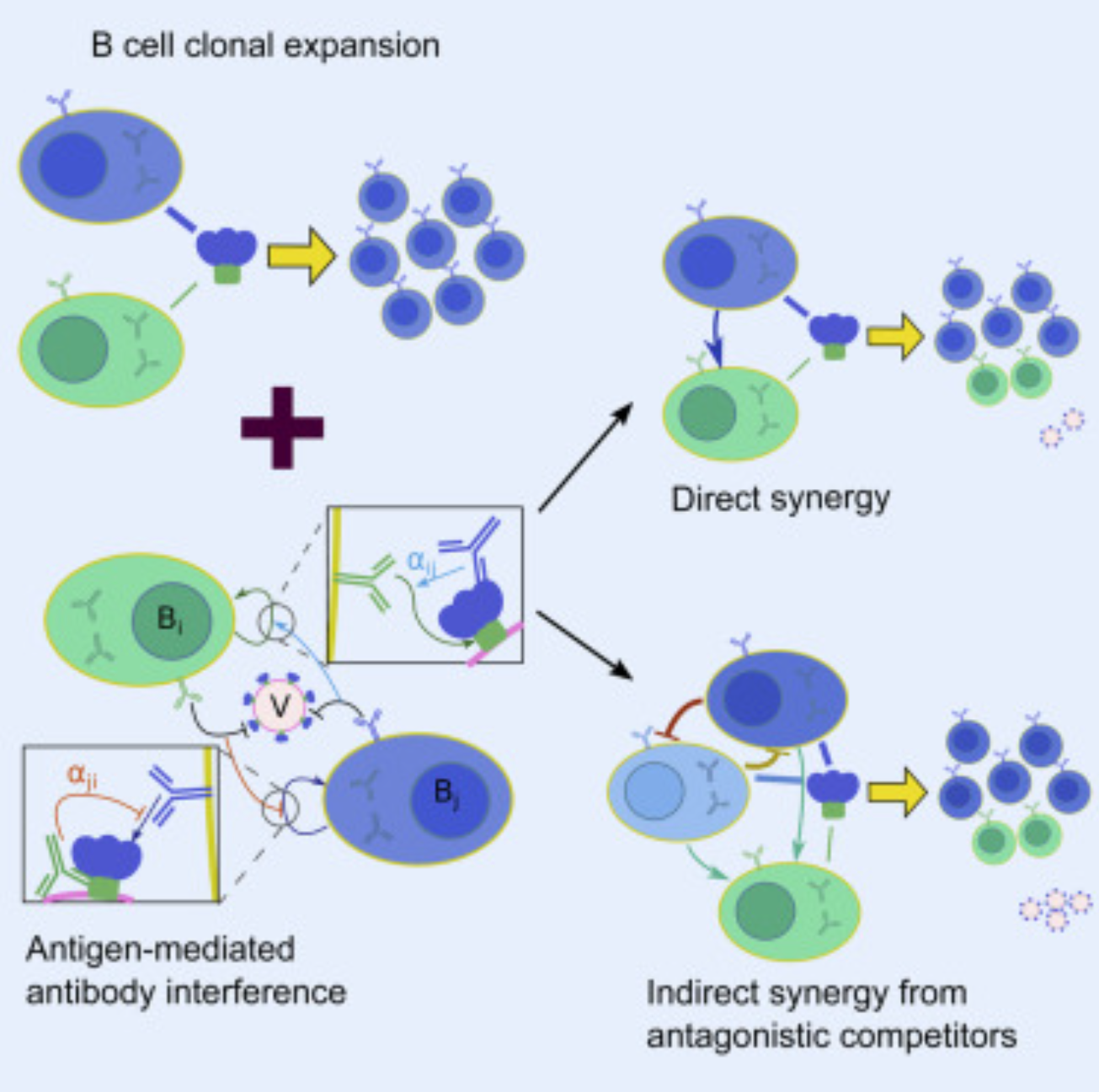
图一 B细胞克隆扩增机制图
二、中和多克隆抗体的制备与筛选策略
传统中和多克隆抗体的制备方式依赖于动物免疫与血清采集,这种方法操作简单,但却存在批次差异明显、成分不清以及伦理方面争议等不足等问题。随着重组抗体技术与B细胞筛选方法的不断突破,当前已开发出多种高效获取重组中和多克隆抗体的技术策略。例如,可以从康复患者或免疫动物的外周血里可分离出抗原特异性记忆B细胞或浆细胞,借助PCR技术扩增这类细胞的抗体可变区基因,再利用噬菌体展示或酵母展示技术构建多样化抗体库,最终可以筛选得到拥有高中和活性的抗体组合。
为了更深入优化抗体的中和广度与协同效应,可运用表位分组分析技术把筛选获得的单克隆抗体依据结合表位分类,从中选取能覆盖不同关键表位的抗体组分,并重新组合成具备理性设计特征的多克隆混合物。这种策略保留了多表位识别的优势,也实现了抗体组成可控、质量稳定的生产目标,为中和多克隆抗体的标准化推进及临床应用打下了基础。
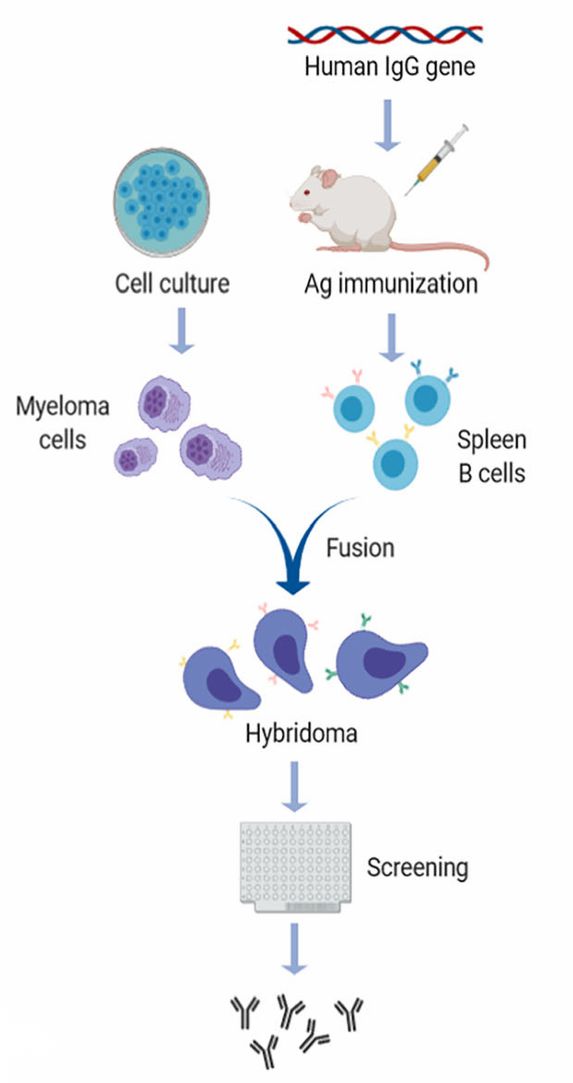
图二 人源化抗体生产
三、抗体功能评价与表位解析技术
得到候选的多克隆抗体后,研究人员需要对它们的结合能力、中和效果、作用机制等方面进行详细的评估,通过假病毒中和试验、空斑减少中和试验和实时细胞感染分析等方法分析中和活性,计算并客观了解抗体抑制病原体感染的实际能力。同时,还需要分析抗体与抗原的结合亲和力以及是否会引发抗体依赖性的增强效应,这样才能全面保证其治疗效果和使用安全性。
确定抗体混合物中各成分针对的抗原表位是弄清楚其作用机制的关键,使用竞争 ELISA、肽扫描技术等方法可以准确地找出抗体结合的功能性表位并评估这些表位的多样性和互补性。理想的中和多克隆抗体制剂应能覆盖多个不重叠的中和表位,而且不同的成分之间能产生明显的协同作用,以此最大程度提高治疗效果并降低耐药风险。
四、应用前景
中和多克隆抗体在抗感染范畴内,特别是新发及突发传染病防控中呈现出广阔的应用前景。例如,再应对SARS-CoV-2变异毒株时,多种针对病毒Spike蛋白不同保守表位的单克隆抗体组合形成的鸡尾酒疗法,已体现出比单一抗体更强的中和效能与抗变异效能。这类策略也用于埃博拉病毒、狂犬病毒等疾病的治疗及预防相关研究,凸显出多表位中和策略的通用属性与实用价值。
卡梅德生物已搭建起涵盖人源化动物免疫、B 细胞单克隆筛选及重组表达的完整技术体系,专注于推进高性能中和多克隆抗体的研发及应用。
参考文献
[1] Julg B, Barouch D. Broadly neutralizing antibodies for HIV-1 prevention and therapy. Semin Immunol. 2021 Jan;51:101475
[2] Ali MG, Zhang Z, Gao Q, Pan M, Rowan EG, Zhang J. Recent advances in therapeutic applications of neutralizing antibodies for virus infections: an overview. Immunol Res. 2020 Dec;68(6):325-339.
[3] Tiller T, Meffre E, Yurasov S, et al. Efficient generation of monoclonal antibodies from single human B cells by single cell RT-PCR and expression vector cloning. J Immunol Methods. 2008 Jan 1;329(1-2):112-24.
[4] Yan L, Wang S. Shaping Polyclonal Responses via Antigen-Mediated Antibody Interference. iScience. 2020 Sep 17;23(10):101568.
常见问题解答
Q1:该如何理解中和多克隆抗体与日常接触的抗体药物的区别?
A1:日常接触的抗体药物多为单克隆抗体,好比 “精准打击单一目标”,仅针对病原体的一个特定位点发挥作用;而中和多克隆抗体更像 “多方位协同防御”,能同时作用于病原体的多个位点。两者核心区别在于覆盖范围和抗变异能力:单克隆抗体适合靶点明确、变异少的情况,中和多克隆抗体则因能覆盖多个位点,更适合应对流感、新冠这类易变异的常见病原体,可减少病毒 “逃逸” 导致药效失效的情况。
Q2:科研团队选择制备中和多克隆抗体的技术路线时,优先参考哪些因素?
A2:优先参考三个核心因素:一是研究目标,若需快速获取基础研究用抗体,可考虑传统动物免疫法;若追求成分可控、适合后续精密实验(如表位分析),则优先选重组抗体技术(如B细胞筛选结合噬菌体展示)。二是样本量需求,小样本探索性研究可简化流程,大样本批量制备需侧重技术的稳定性和可重复性。三是后续应用场景,若用于体外检测实验,需关注抗体纯度;若用于细胞水平实验,还需确认抗体无细胞毒性,围绕 “目标-样本-应用” 匹配。
Q3:科研中想将中和多克隆抗体与流式细胞术结合使用,需先做哪些适配性验证?
A3:需完成三项基础验证:一是抗体标记兼容性验证,确认抗体是否可被流式检测用的荧光素(如 FITC、PE)标记,或已标记抗体与流式抗体的荧光通道无重叠;二是浓度优化,用不同浓度的抗体与靶细胞孵育,通过流式检测确定能产生清晰阳性信号且非特异性结合低的最佳抗体浓度;三是阴性对照验证,设置未加抗体的靶细胞组、加无关抗体的对照组,排除非特异性结合对结果的干扰。
Q4:假病毒中和试验评估抗体活性,背后的方法原理是什么?为何常用该方法?
A4:原理是利用 “假病毒” 的特性:假病毒保留目标病毒的包膜蛋白(能与宿主细胞结合),但不含病毒复制所需的关键基因,无法在细胞内大量复制,安全性高。实验时,让抗体与假病毒混合,若抗体能中和病毒,会与假病毒包膜蛋白结合,阻止其黏附、进入宿主细胞;后续通过检测细胞内假病毒携带的报告基因(如荧光基因)信号强度,就能判断抗体的中和能力 —— 信号越弱,说明抗体阻止假病毒感染细胞的效果越好。常用是因它既规避了活病毒的生物安全风险,又能模拟真实病毒的感染过程,结果贴合实际中和效果。
- 中和多克隆抗体
- 抗体制备与筛选
- 抗体应用
- 抗体开发
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





