利用免疫和合成VHH噬菌体展示文库加速VHH发现
- 2026-01-28
- 48
一.VHH的发现
1993年,Hamers团队在《自然》杂志上发表了题为 “Naturally occurring antibodies devoid of light chains” 的划时代论文。他们证实,骆驼科动物体内存在一类独特的抗体,它们完全由两条重链组成,没有轻链,因此,其抗原结合部位仅由一个单一的重链可变区(VH)构成。尽管结构简化,但VH依然能形成完整、高亲和力的抗原结合口袋。这颠覆了传统抗体必须由轻重链可变区共同构成结合位点的认知。于是在重链抗体走进人们视野后,科学家们又大胆猜测单独的重链可变区(VHH)是否也同样能够稳定地结合抗原呢?后面这一猜想也得到了了证实。几乎在骆驼VHH被深入研究的同时,科学家在鲨鱼等软骨鱼类的血液中也发现了功能类似的单域抗体,称为“VNAR”。这证明了“单域抗体”策略在脊椎动物免疫系统中是独立进化了至少两次的成功方案,也反向印证了其生物学合理性和优势。
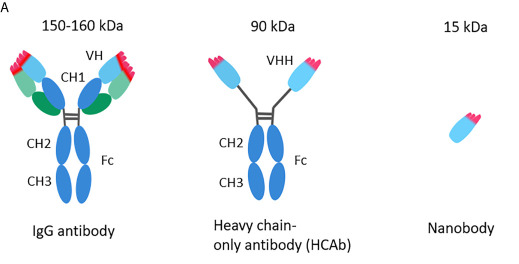
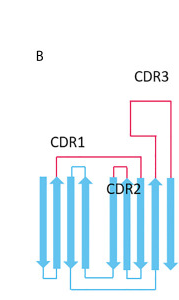
图1:VHH抗体的结构(文献[1])
二.VHH噬菌体展示文库的创造
VHH的潜在优势有体积小、稳定性高、易于克隆和表达等,虽然VHH有这些天然属性,但要成为广泛应用的工具,需要建立稳定的生产平台,于是研究人员将VHH基因与噬菌体展示技术相结合。
1. PBMC的获得
由于B淋巴细胞或浆细胞很难被单独分离出来,所以根据需求的不同可以从未经免疫刺激的羊驼或经抗原免疫的羊驼体内收集外周血并分离其外周血单个核细胞(PBMC),从其中获取抗体的信息。
2. cDNA文库的制备
从分离出的PBMC中提取总的RNA,并用逆转录试剂盒将RNA逆转录成cDNA,抗体的cDNA文库制备完成后可放置在-80℃冰箱妥善保存,用于后续噬菌体文库的构建。
3. VHH序列的获得
VHH序列较短,单次PCR很难直接进行准确扩增,需要采用巢式PCR的方式进行精准扩增。巢式PCR有2对扩增引物,第一对引物扩增出较长的片段,扩增区域大致有2种,分别为VHH-CH1-铰链-CH2区及VHH-铰链-CH2区,其作用很像“放大镜”将有效序列的区域进行定位及放大;第二对引物设计在第一次PCR产物序列内,可以更加精准的对VHH序列进行扩增。
4. 噬菌体展示文库的制备
在第二次PCR时设计的巢式引物会引入载体上的酶切位点,所以PCR终产物需经酶切后与噬菌体载体进行连接,卡梅德生物采用pMECS载体进行文库制备,质粒文库构建完成后,将其转化到大肠杆菌中,在辅助质粒的作用下进行噬菌体包装,包装及扩增后的噬菌体表面携带有VHH抗体及便于检测的标签抗体,经库容鉴定、插入率鉴定及多样性鉴定合格后,标志着VHH文库构建完成,VHH噬菌体展示技术成功应用,为下游的抗体生产奠定基础。
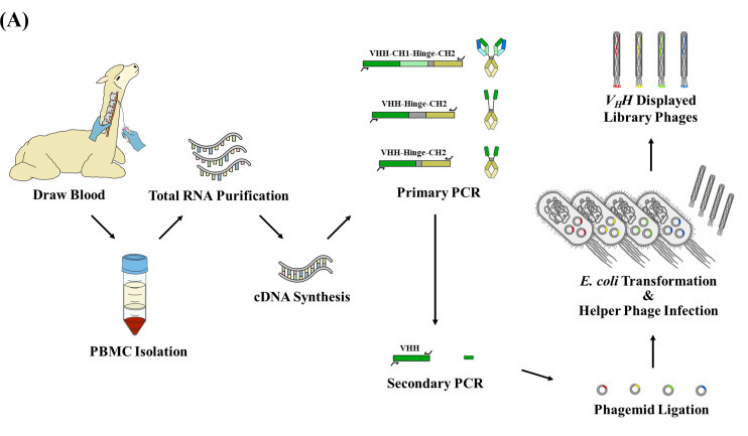
图2:VHH噬菌体文库构建过程(文献[3])
三.VHH抗体生产
VHH文库构建完成后,利用抗原作为“诱饵”,从这个庞大的库中“钓出”那些表面展示着能结合该抗原的抗体片段的噬菌体。整个过程大致分为“吸附-洗涤-洗脱-扩增”的循环过程,又称为“淘选”过程。随着淘选次数的增加,特异性高,亲和力强的噬菌体被富集并得到,我们通过ELISA的方式对筛选到的噬菌体进行初步验证,对其与靶标的结合能力进行进一步作证。将高亲和力的噬菌体基因组进行测序分析,从测序出的序列中对被展示的VHH序列进行定点提取,通过原核表达系统、真核表达系统或哺乳动物细胞表达系统等方式进行VHH抗体生产,通常我们会选用哺乳动物细胞表达系统进行抗体生产,最大程度地保留VHH的空间结构,且其后续亲和力的验证效果也相对较好。
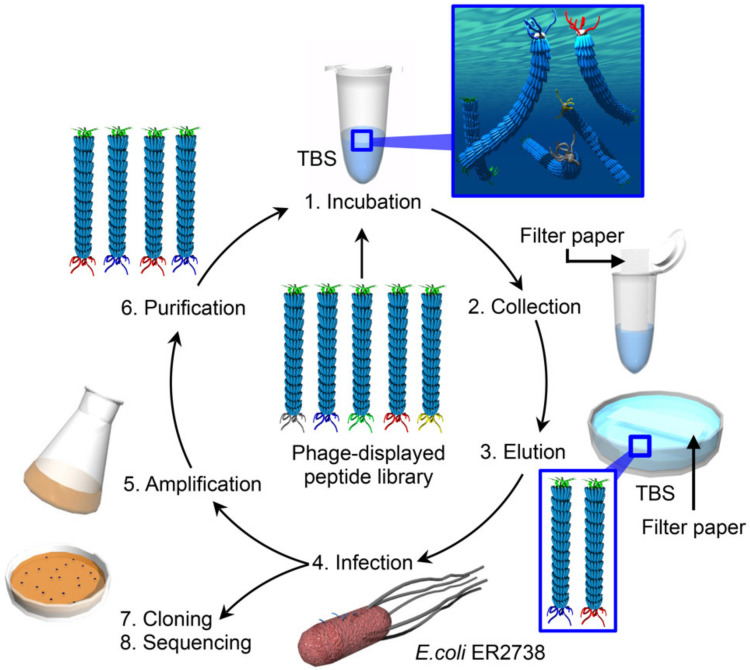
图3:VHH噬菌体文库筛选过程(文献[4])
引用:
[1] Chen F, Liu Z, Jiang F. Prospects of Neutralizing Nanobodies Against SARS-CoV-2. Front Immunol. 2021 May 28;12:690742. doi: 10.3389/fimmu.2021.690742. PMID: 34122456; PMCID: PMC8194341.
[2] Narutoshi Tsukahara, Akikazu Murakami, Maiko Motohashi, Hiroshi Nakayama, Yoshiro Kondo, Yuji Ito, Takachika Azuma, Hidehiro Kishimoto, An alpaca single-domain antibody (VHH) phage display library constructed by CDR shuffling provided high-affinity VHHs against desired protein antigens, International Immunology, Volume 34, Issue 8, August 2022, Pages 421–434, https://doi.org/10.1093/intimm/dxac022
[3] Wang W-C, Chang J, Lee C-H, Chiang Y-W, Leu S-J, Mao Y-C, Chiang J-R, Yang C-K, Wu C-J, Yang Y-Y. Phage display-derived alpaca nanobodies as potential therapeutics for Naja atra snake envenomation. Appl Environ Microbiol. 2024 Aug 21;90(8):e0012124. doi: 10.1128/aem.00121-24. Epub 2024 Jul 9. PMID: 38980046; PMCID: PMC11337809.
[4] Sawada T, Oyama R, Tanaka M, Serizawa T. Discovery of Surfactant-Like Peptides from a Phage-Displayed Peptide Library. Viruses. 2020 Dec 15;12(12):1442.
- VHH发现
- VHH文库构建
- VHH噬菌体展示
- VHH抗体生产
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





