CRISPR_Cas9技术在细胞系基因编辑中的应用
- 2025-12-03
- 383
CRISPR/Cas9技术是具有革命性意义的基因编辑技术,这一技术体系最初源自细菌的适应性免疫机制,经科研人员工程化改造后,可在真核细胞内完成基因组的精准定位与切割操作,并为基因功能研究和疾病模型构建提供了强有力的技术支撑。
一、CRISPR/Cas9技术原理与工作机制
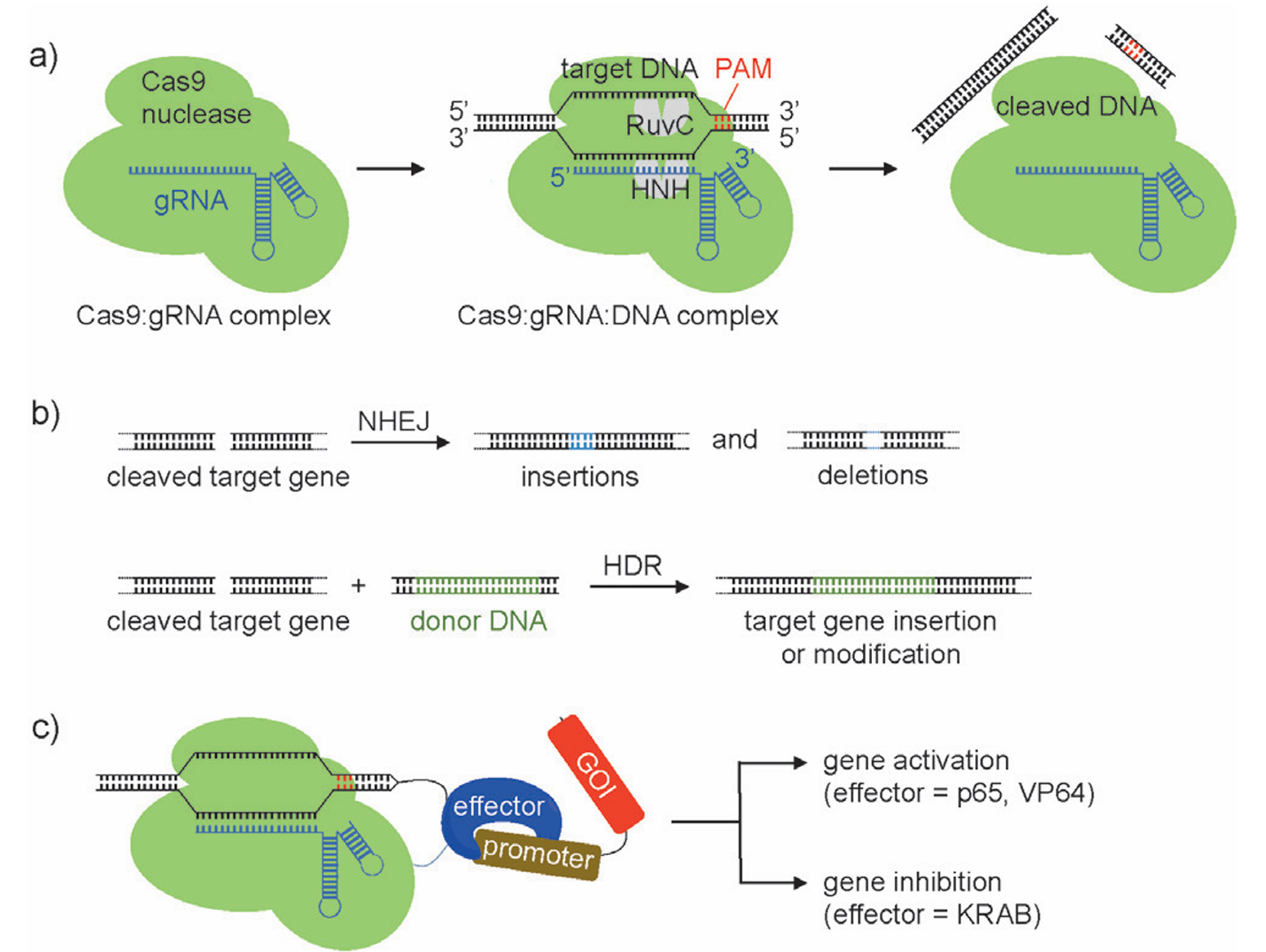
CRISPR/Cas9系统的核心由两个部分组成:引导RNA(sgRNA)和Cas9核酸酶。sgRNA通过约20个核苷酸的靶向序列识别特定基因组位点,将Cas9核酸酶精准引导至目标位置。其工作机制具有以下特点:
1. sgRNA通过碱基互补配对原则与目标DNA序列结合
2. Cas9核酸酶在PAM序列上游的特定位点切割DNA双链
3. 细胞通过两种主要修复机制响应DNA双链断裂
细胞针对这类DNA损伤具备两种主要修复机制:非同源末端连接是一种易错的修复方式,常常会造成插入或缺失突变,可用于实现基因敲除;同源定向修复需提供外源修复模板,可以实现特定基因的精准插入或替换。
在细胞系基因编辑领域,CRISPR/Cas9技术已经展现出巨大的应用价值。其中几个重要应用方向包括:基因敲除细胞系构建:通过设计针对特定基因外显子的gRNA,利用NHEJ修复途径引入移码突变;基因敲入与定点修饰:通过同源定向修复机制在基因组特定位点精确引入外源序列;疾病模型构建:创建用于研究人类疾病机制的CRISPR细胞系。
基因敲除技术是应用最广泛的手段之一。研究人员通常建议对每个靶点设计若干种不同的gRNA分子,并靶向早期组成型外显子区域,以提升成功概率。而CHO细胞系的构建过程中,借助CRISPR介导的HDR技术将治疗性蛋白相关基因精确导入基因组特定区域,达成稳定且高效的蛋白质表达效果。
CRISPR细胞系是疾病模型构建领域研究人类疾病作用机制的关键工具。科研工作者运用CRISPR/Cas9技术在人类造血干细胞中成功模拟染色体易位现象,建立起研究白血病发生早期分子事件的模型体系。这类精心设计的CRISPR细胞系为深入理解血液系统恶性肿瘤发病机理提供了独特的研究平台。
二、CRISPR/Cas9技术优化与创新进展
随着CRISPR技术的广泛应用,研究人员不断优化编辑效率并拓展其功能。技术优化的主要方向包括:
1. 新型Cas9变体的开发:通过蛋白质工程技术改良编辑特性
2. 递送系统的优化:提高CRISPR组分进入细胞的效率
3. 脱靶效应的控制:确保基因编辑的精确性和安全性
新式 Cas9 突变体的研发是当下科研热点之一。科研人员借助蛋白质工程技术研制出多种带改良属性的Cas9突变体,例如拥有更强编辑效能与更广PAM识别区间的变体。递送体系的优化改进也是提高CRISPR基因编辑效能的核心要素,当前常用的递送方式包含病毒递送与非病毒途径,专业的CRISPR服务机构常会依据具体细胞种类和实验需求为客户推选最适配的输送方案。
科研人员为应对脱靶效应这一技术难题研发出各类策略:改良 gRNA设计、采用高保真Cas9突变体及调控CRISPR组分表达量等方法都能够切实减少脱靶的风险。此外,全基因组sgRNA文库筛选服务的问世让科研人员可更迅捷地辨别最有效的gRNA序列,显著提升了CRISPR细胞系构建的成功概率。
三、CRISPR/Cas9基因编辑应用前景
CRISPR/Cas9技术在细胞系编辑中的应用前景十分广阔,主要体现在以下领域:
⇒ 基础研究:基因功能鉴定和信号通路解析
⇒ 疾病建模:创建各种遗传性疾病模型,为药物筛选和治疗方法开发提供重要平台
⇒ 生物技术:开发高效表达治疗性蛋白的细胞系,推动生物制药产业的进步。

卡梅德生物为研究人员提供了全方位的技术支持。我们可提供从sgRNA设计验证到单克隆制备的一站式解决方案,可大大降低研究人员开展基因编辑项目的技术门槛。除了基因编辑细胞系以外,我们还提供多种CRISPR服务,如植物基因编辑、动物基因编辑以及微生物基因编辑等,为研究者们提供更加全面完善的服务。
参考文献
[1] Zhou W, Deiters A. Conditional Control of CRISPR/Cas9 Function. Angew Chem Int Ed Engl. 2016 Apr 25;55(18):5394-9.
[2] Bhattacharjee G, Gohil N, Khambhati K, et al. Current approaches in CRISPR-Cas9 mediated gene editing for biomedical and therapeutic applications. J Control Release. 2022 Mar;343:703-723.
[3] Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science.
[4] Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 2013 Feb 15;339(6121):819-23.
[5] Ronda C, Pedersen LE, Hansen HG, et al. Accelerating genome editing in CHO cells using CRISPR Cas9 and CRISPy, a web-based target finding tool. Biotechnol Bioeng. 2014 Aug;111(8):1604-16.
- CRISPR/Cas9技术
- 基因编辑服务
- sgRNA
- CRISPR细胞系
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





