scfv抗体的人源化技术解析
- 2025-12-10
- 196
随着治疗性抗体需求的日益增长,如何降低单链抗体的免疫原性已成为生物制药领域的关键挑战。
单链可变区片段(single-chain variable fragment,scFv)凭借分子量低、组织穿透能力优异、易于基因工程修饰改造的特性,现已成为生物制药领域治疗性抗体研发的核心方向之一。然而,早期研发的scFv抗体多为鼠源抗体,进入人体后易引发免疫应答,制约临床转化与应用。scFv抗体人源化技术通过分子层面的修饰优化,在维持scFv抗体高亲和力特性的基础上,大幅降低其免疫原性,为治疗性抗体研发提供了全新的思路与方向。
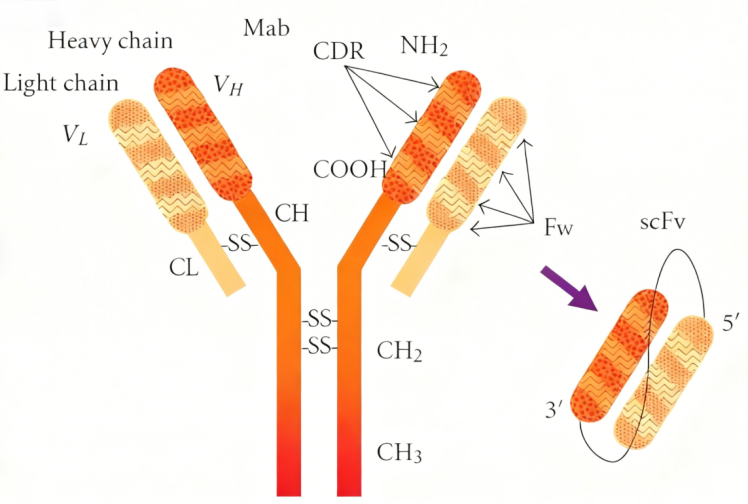
图1 scFv的结构
一、scFv抗体的结构与优势
要理解scFv抗体的人源化技术,首先需了解其基本结构与功能特性。scFv抗体由重链可变区(VH)和轻链可变区(VL)通过一条约15-25个氨基酸的柔性连接肽共价连接而成。
这种紧凑结构使scFv抗体在保留抗原结合能力的同时,具有诸多优势:
● 分子量小:仅为完整IgG分子的约1/6,具有更佳的组织穿透能力
● 免疫原性低:相较于鼠源全长抗体,scFv抗体的人源化改造更为简便
● 生产成本低:易于在原核系统中进行重组表达,适合大规模生产
● 灵活性高:可作为构建模块用于开发双特异性抗体、CAR-T细胞受体等更复杂的治疗制剂
在临床前研究阶段,scFv抗体已显现出可观的应用价值,而非人源scFv抗体进入人体后可能诱发抗药物抗体反应,对治疗效果与用药安全性构成影响。scFv抗体人源化成为推动该类抗体走向临床应用的核心环节,系统化抗体人源化修饰能大幅提升scFv抗体生物相容性、延长体内作用时间并减少免疫相关不良事件发生概率。
二、scFv抗体人源化的核心方法
scFv抗体人源化技术旨在最大限度地将非人源scFv抗体改造成接近人源序列,同时保留其原有的抗原结合能力和特异性。目前主要采用以下几种策略:
1. 互补决定区移植
这是最经典和应用最广泛的scFv抗体人源化方法。其过程包括:
● 模板选择:通过序列比对,筛选与鼠源scFv抗体可变区同源性最高的人源抗体框架作为接受体
● CDR移植:将鼠源scFv抗体的互补决定区完整移植到选定的人源框架上
● 关键残基回溯突变:对影响CDR环构象的关键框架残基进行回溯突变,以维持抗原结合活性
研究表明,合理选择回溯突变位点对于维持人源化后scFv抗体的亲和力至关重要。
2. 表位导向与表面重塑技术
随着结构生物学和生物信息学的发展,新一代scFv抗体人源化技术更加注重三维结构信息:
● 表位导向人源化:通过分析抗原-抗体复合物结构,精确识别参与结合的关键残基,实现最小化移植
● 表面重塑技术:专注于替换scFv抗体表面暴露的残基,降低免疫原性,同时保留内部关键结构残基
3. 抗体库优化法
此法结合CDR移植与噬菌体展示技术,同步实现人源化和优化非人源氨基酸残基。
操作流程包括:构建人源化组合抗体库-通过抗原筛选阳性克隆-获得高亲和力、低免疫原性的人源化scFv抗体。
研究表明,此法能成功获得与亲本抗体具有相似抗原结合特异性和亲和力的人源化变体。
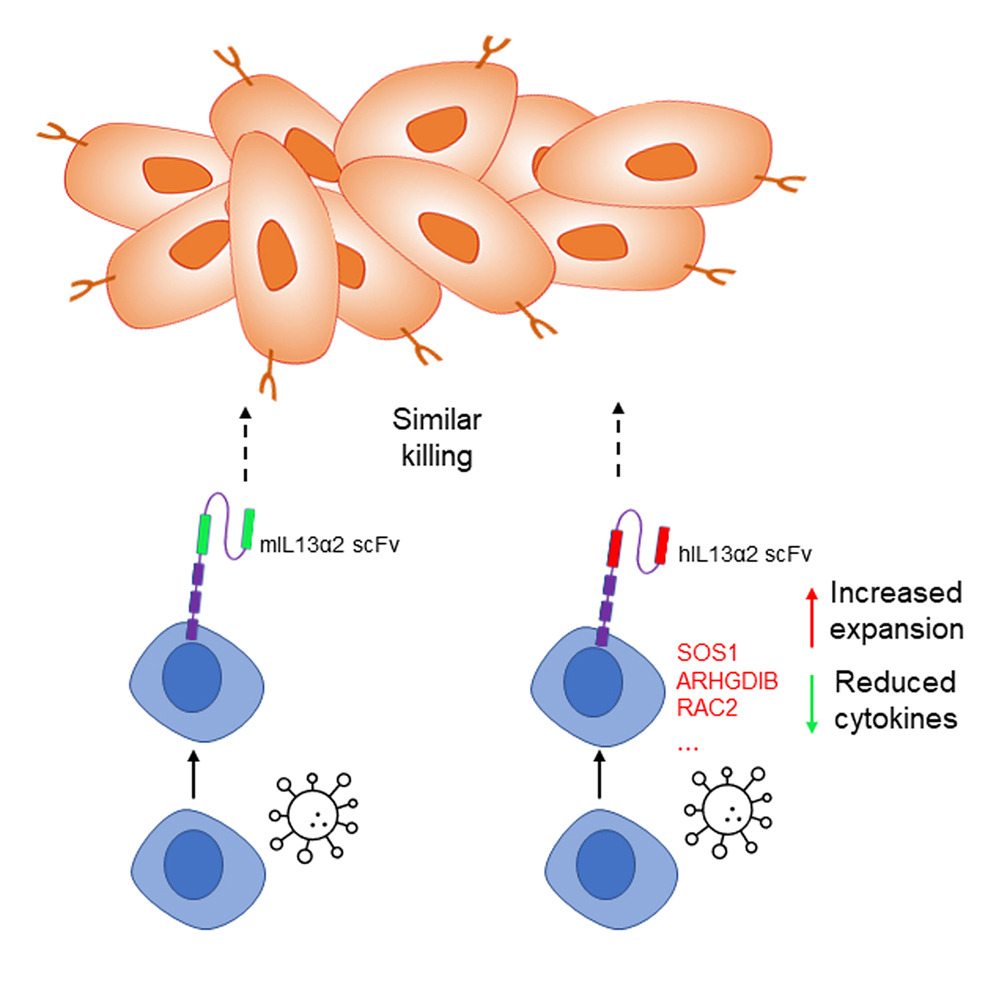
图2 hIL13a2与mIL13a2 scFv修饰免疫细胞
三、人源化过程的技术挑战与应对
scFv抗体人源化过程中常遇到亲和力损失和稳定性下降等技术难题,主要源于框架残基对CDR区构象的细微影响,以及连接肽与人源框架的兼容性问题。
1. 亲和力维持策略
为应对亲和力损失,研究人员开发了多种有效策略:
● 建立合理的回溯突变库:系统性筛选对CDR环构象有关键影响的残基
● 采用定向进化技术:通过多轮筛选获得最优变体
● 利用分子动力学模拟:预测可能影响稳定性的位点
一项关于抗IFN-α2 scFv人源化的研究显示,通过合理的回溯突变设计,可显著减少人源化后亲和力的损失。
2. 免疫原性控制
尽管抗体人源化显著降低了免疫原性,但完全消除仍具挑战。我们建立了完整的免疫原性控制体系:
● T细胞表位预测:采用多种算法交叉验证,识别潜在免疫原性序列
● 人源化设计-验证平台:实现从序列设计到功能验证的全流程优化
● 临床前评价模型:通过体外免疫细胞活化实验评估免疫原性风险
这些策略在针对肿瘤相关抗原的scFv抗体人源化项目中得到验证,获得的多种人源化scFv抗体在临床前研究中显示出低免疫原性和高生物活性的理想特性。
scFv抗体人源化技术已发展成为生物制药企业的核心技术能力,为创新抗体药物的开发提供了重要支撑。除此以外,卡梅德生物还提供scFv抗体表达服务和抗体亲和力成熟服务,为研究者提供全方面的服务。
参考文献
[1] Elter A, Bogen JP, Hinz SC, et al. Humanization of Chicken-Derived scFv Using Yeast Surface Display and NGS Data Mining. Biotechnol J. 2021 Mar;16(3):e2000231.
[2] Caldas C, Coelho V, Kalil J, Moro AM, Maranhão AQ, Brígido MM. Humanization of the anti-CD18 antibody 6.7: an unexpected effect of a framework residue in binding to antigen. Mol Immunol. 2003 May;39(15):941-52.
[3] Aubrey N, Billiald P. Antibody Fragments Humanization: Beginning with the End in Mind. Methods Mol Biol. 2019;1904:231-252.
[4] Gupta P, Horspool AM, Trivedi G, et al. Matrixed CDR grafting: A neoclassical framework for antibody humanization and developability. J Biol Chem. 2024 Jan;300(1):105555.
[5] Xu Y, Jiang H, Chen L, Zhou F, Jin Y, Chiu ML. Engineering tandem VHHs to target different epitopes to enhance antibody-dependent cell-mediated cytotoxicity. FEBS Open Bio. 2025 Nov 20.
[6] Xu C, Bai Y, An Z, Hu Y, Zhang C, Zhong X. IL-13Rα2 humanized scFv-based CAR-T cells exhibit therapeutic activity against glioblastoma. Mol Ther Oncolytics. 2022 Jan 10;24:443-451.
- scFv抗体
- 抗体人源化
- 人源化服务
- 亲和力
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





