重组抗体的开发与制备
- 2025-10-24
- 201
抗体是由经过机体的免疫反应,由B淋巴细胞分化成熟的浆细胞产生并分泌的一类免疫球蛋白。近些年来为了更好地利用某种抗体的特异性功能,将天然抗体在体外进行修饰改造,保留其功能及特点,同时增强其在体外的稳定性,改造后的抗体即为重组抗体,通过不断地技术优化可以实现大批量重组抗体生产,推动生物学及医学领域的诊疗研究。
重组抗体分类及其特点
1.嵌合抗体、人源化抗体及全人源化抗体
嵌合抗体是将天然抗体的抗体可变区替换为其他物种的序列,比如人-鼠嵌合抗体的制备就是将鼠源抗体的可变区与人源的Ig恒定区进行重组,得到新的重组抗体,新的重组抗体可以减少人体的免疫排斥反应,比较成功的案例就是利妥昔单抗。抗体嵌合是抗体人源转化的第一仗。
人源化抗体是将异种来源的抗体可变区的CDR区进行修饰或替换使其具有人源化特性,典型案例是曲妥珠单抗,其将人源单抗可变区的CDR代替鼠源的,更大程度地减少了人体的免疫反应。
全人源化抗体是将人的B细胞与骨髓瘤细胞融合,以生产全人源的单抗药物,但是二者是很难融合的,但是随着科学研究的不断推进,可以采用噬菌体展示抗体库或转基因小鼠等技术实现全人源抗体的生产制备。
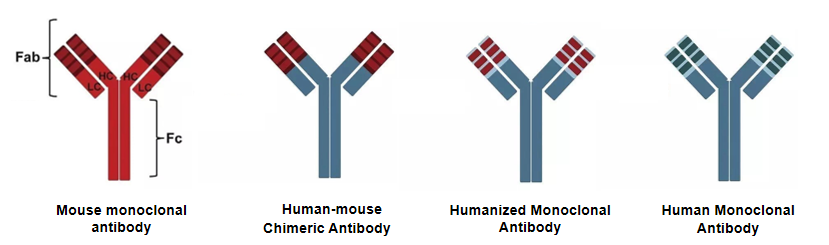
图1.抗体人源化历程
2.小分子抗体
小分子抗体是指scFv抗体和VHH抗体。scFv抗体直接将重链可变区和轻链可变区用柔性Linker相连在一起。由于缺少Fc片段,scFv抗体的免疫原性会更小,大大减弱机体的免疫反应,是抗体免疫治疗的新选择。
相较于scFv抗体,VHH抗体分子量更小,仅由一个抗体重链可变区构成,是抗原的最小结合单元。与传统的抗体相比,VHH的CDR3区的长度会更长,可以更好地结合机体更深层次的抗原表位。VHH的出现使抗体在体内外的诊疗研究变得更加火热。
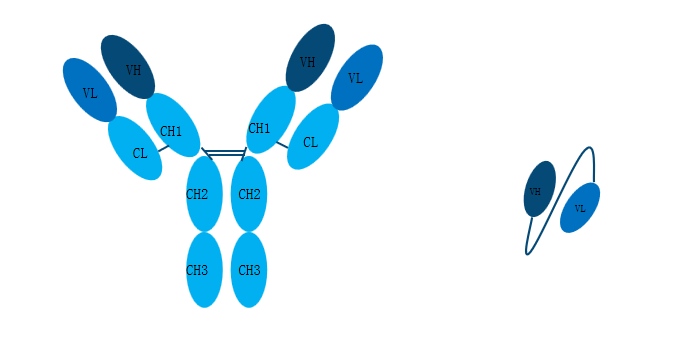
图2.常规抗体及scFv抗体
3.双特异性抗体
双特异性抗体是通过基因工程技术在同一个抗体表达载体上偶联两个不同抗原或同一抗原的两个不同表位的抗原结合区,在体外进行表达的重组抗体。双特异性抗体的结合性和靶向性相对于传统的抗体而言,表现得更为强烈。双特异性抗体根据融合的靶点抗体的不同可以发挥不一样的作用,比如靶向癌细胞表面抗体片段与靶向T细胞表面免疫检查点抗体片段进行偶联,可以招募T细胞靶向杀伤肿瘤细胞。目前的研究不仅集中在双特异性单克隆抗体上,双特异性重链抗体和双特异性纳米抗体的关注度也持续增长。
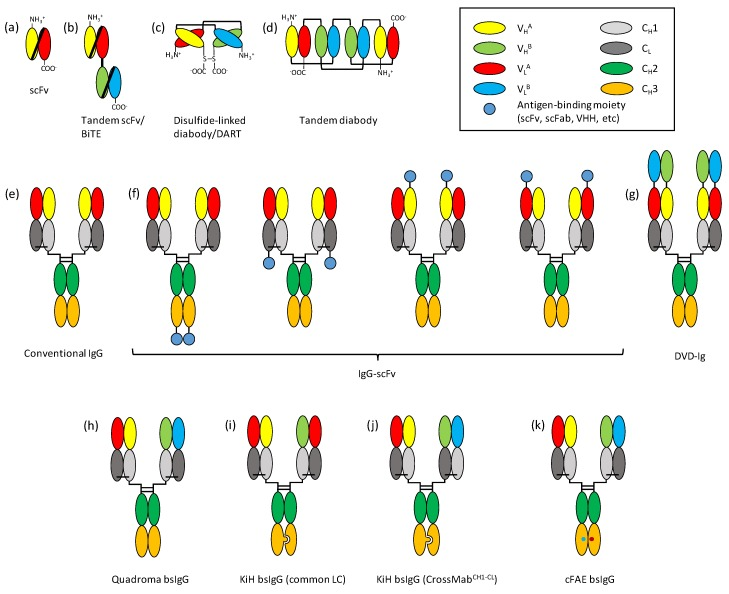
图3.不同类型的双特异性抗体
卡梅德生物拥有完善的重组抗体表达与重组抗体生产平台,丰富的重组抗体表达经验,能够为客户提供各种种属的全长和scFv、Fab、VHH纳米抗体、双特异性抗体、Fc融合抗体、嵌合抗体制备服务,客户只需提供抗体序列、杂交瘤细胞或 cDNA 信息。公司的技术支持可以根据客户的需求进行方案设计,结合公司自主设计的哺乳体系高表达载体和大规模重组抗体发酵平台,为客户提供包含序列分析、linker设计、融合标签设计,高表达载体设计构建、表达方案设计优化、重组表达条件优化、抗体纯化等高质量的一站式重组抗体生产服务。
引用:
[1] Lo KM, Leger O, Hock B. Antibody Engineering. Microbiol Spectr. 2014 Feb;2(1):AID-0007-2012.
[2] Shim H. Bispecific Antibodies and Antibody-Drug Conjugates for Cancer Therapy: Technological Considerations. Biomolecules. 2020 Feb 26;10(3):360.
[3] Drugs and Lactation Database (LactMed®) [Internet]. Bethesda (MD): National Institute of Child Health and Human Development; 2006–. Rituximab. 2025 Feb 15.
常见问题解答
Q1:抗体重组表达时表达量比较低的解决方法?
A1:第一,在最初选择表达系统的时候可以根据后续的应用场景选择合适的表达体系,如果该抗体不需要进行复杂的动物实验或抗体为VHH抗体则可以放弃哺乳表达选择原核表达体系进行表达,这样一来表达量会提高很多。第二,必须选用哺乳表达时可以在重组表达载体构建过程中偶联大标签,比如Fc标签促进抗体蛋白的可溶性表达,同时还可以促进小抗体蛋白结构的稳定性。第三,在表达载体的选择上,如果现有的启动子诱导的抗体表达量少可以更换含有其他启动子的载体,因为抗体序列之间是存在差异的,SV40的表达量比较低,一般选择CMV或CAG启动子。第四,转染试剂的选择很重要,表达量少时可以适当增加转染试剂的用量,或者换一种更高效的转染试剂。
Q2:在重组抗体生产过程中如何提高抗体蛋白纯度?
A2:在进行亲和纯化过程中,抗体纯度很低可能是由于抗体本身表达量不够,可以通过改善蛋白表达量实现蛋白纯度的提升。除此之外在纯化过程中,可以先用小浓度的洗脱液进行洗涤,去除杂蛋白,再用高浓度的洗脱液进行目标抗体的洗脱。以上方法若不能达到目的还可以进行分子筛,不过在实验过程中有可能会有很多抗体的损耗。
Q3:Ni-NTA纯化后抗体缓冲液中咪唑的去除方式有哪些?
A3:最传统的方式就是透析,配制想要的不含咪唑的缓冲液,将纯化后的抗体装到相应孔径的透析袋中,利用透析内外咪唑的浓度差对咪唑进行去除。但是这种方法耗时比较长,在这期间抗体可能有损耗。除此之外可以利用超滤管,在对抗体进行浓缩的同时将抗体缓冲液进行置换,这种方法可以节省时间,相对高效。值得注意的是,如果抗体后续需要用于细胞或动物实验,那咪唑一定要尽可能地处理干净,因为咪唑会造成细胞或组织坏死。
- 抗体表达
- 重组抗体
- 双特异性抗体
- 小分子抗体
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





