浅谈双特异性抗体开发
- 2025-11-05
- 168
一、双特异性抗体概述
双特异性抗体是人工工程化的抗体分子,最大的特点是能在同一个分子中,同时把两种不同的抗原或同一抗原的两个不同的表位结合,突破了天然单克隆抗体“单靶点”的限制,开辟了疾病治疗的新思路。
按逻辑结构上的设计原理看,BsAb是将两种不同来源的Fab抗原结合区(来源于不同的亲本单抗)组装成一个功能分子。这种新型结构具有一种新性质,即能同时作用于两种靶点,可以将T细胞重新导向肿瘤位置,发挥杀伤作用,或者是同时阻断两条不同的信号通路,比如针对某个重要通路上的两个重要的靶向蛋白,一起发挥更强大的作用。
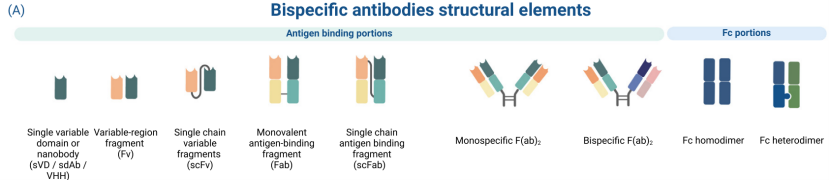
图1 双特异性抗体设计结构图
二、双抗结构特征
双特异性抗体的结构特征是其功能多样性的基础,其核心设计目标是将两个不同的抗原结合域(Variable Domain,可变区)精准地组合在一个分子中。根据结构是否含有天然IgG的Fc区域,主要可分为两大类:含Fc区的IgG样双抗和不含Fc区的非IgG样(小型化)双抗。
由于IgG样双抗保留了Fc片段,它的血清半衰期比较长(主要是通过一种被称为FcRn的回收机制),能够发挥Fc介导的各种效应作用,比如ADCC。然而非IgG样双抗分子量更小,穿越肿瘤组织的能力更强,半衰期较短,通常需要通过将它与白蛋白融合或是PEG化来提高药动学性质,同时还要保证在生产中能够配对得到正确的重链和轻链。但是在结构设计上会有一个大的难点,即如何防止二者之间错误配对。为了使产品质量更加稳定、均一,很多研究者采用了各种各样的手段,其中比较有代表性的是“杵-臼”的结构设计或者电荷斥力机制。
三、双抗作用原理机制
双特异性抗体核心的作用机制是精准的“分子桥梁”,可以通过这个分子桥梁来达到单抗不能实现的一些非常复杂的药效学功能,主要有以下几种类型:
1.最经典的机制是免疫细胞重定向。例如,一款BsAb的一个臂结合T细胞表面的CD3抗原,另一个臂结合肿瘤细胞表面的特定抗原(如CD19)。这样,它就能将细胞毒性T细胞“招募”并激活在肿瘤细胞周围,不受MHC限制性地直接杀伤肿瘤;
2.另一个重要机制就是双靶点信号协同阻断。在BsAb中,将同一个信号通路中两个重要的分子(如VEGF和Ang2)或不同的免疫检查点(如PD-1和CTLA-4)同时结合,可以更好地阻断肿瘤血管生成或打破免疫抑制,产生叠加或协同的治疗效应。
此外,BsAb还用于模拟或者增强天然受体的功能,即将两个不同的受体跨膜信号复合物相互靠拢,触发特异性的细胞功能。由于其独特的功能,可以作为精准医疗的重要工具。
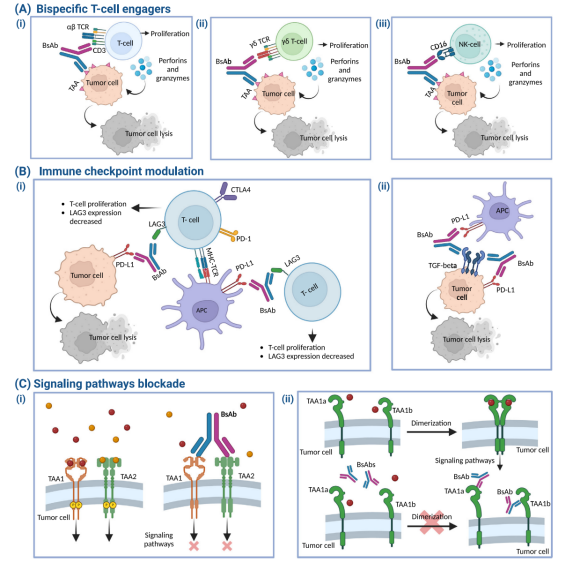
图2 双特异性抗体的作用机制
四、双抗制备策略
双特异性抗体的制备策略主要分为两大类:基于细胞融合的传统技术和主流的重组DNA技术。早期的四交瘤技术通过融合两种分泌不同单抗的杂交瘤细胞,但会随机产生多种错配抗体,产物异质性强、纯化困难,目前已较少使用。
现在大多数的制备方法均是通过基因工程重组技术,在单基因水平设计编码重链及轻链的DNA序列并转染到动物细胞(CHO细胞等)中去表达。关键的问题是链间的匹配,也就是说两个不同的重链要能与之相对应的两个不同的轻链正确匹配。
五、重组双抗表达系统
重组双特异性抗体表达是把双特异性抗体推进到临床的关键环节,其过程需要基因工程和细胞培养系统保证。该表达系统的第一个步骤是通过一系列精确操作将人工设计并优化的靶向双抗重链及轻链的基因插入到适当的表达载体中。现发现哺乳动物细胞双特异性抗体表达体系是制备治疗用双特异性抗体的理想选择。CHO细胞具备对复杂蛋白进行正确折叠、组装和翻译后修饰(如糖基化)的能力,这对于保证双特异性抗体的结构完整性、稳定性和生物学功能至关重要。
采用双特异性抗体表达策略是通过多顺反子载体把两个及以上的蛋白链的基因整合到同一个载体上,也可以通过共转染的方式将几个不同的载体导入到单个宿主细胞内,这样就能够得到含有多条链的重组质粒。再加入相应的选择性压力以及利用高通量克隆筛选的办法,在工程化细胞株中获得能稳定高效表达目标双抗分子的大肠杆菌或者是CHO细胞等,之后再放到生物反应器里面做大量生产。
基于高效的噬菌体展示技术平台,卡梅德生物能够建立多样的抗体文库(独立克隆数可达1011级)。在哺乳动物细胞系的大肠杆菌、酵母等不同表达体系上均有较为丰富的重组双特异性抗体表达优化经验,在充分考虑双抗分子本身的复杂性上选择最为合适的生产路线,保证双抗分子的完整性和活性。卡梅德生物利用严格的质量控制体系为客户提供从基因序列到高质双抗成品的一站式服务。
引用:
[1]Herrera M, Pretelli G, Desai J, et al. Bispecific antibodies: advancing precision oncology. Trends Cancer. 2024; 10(10): 893-919.
[2] Klein C, Brinkmann U, Reichert JM, Kontermann RE. The present and future of bispecific antibodies for cancer therapy. Nat Rev Drug Discov. 2024; 23(4): 301-319.
[3] Lim K, Zhu XS, Zhou D, Ren S, Phipps A. Clinical Pharmacology Strategies for Bispecific Antibody Development: Learnings from FDA-Approved Bispecific Antibodies in Oncology. Clin Pharmacol Ther. 2024; 116(2): 315-327.
- 双特异性抗体
- 抗体制备
- 抗体表达
- 抗体开发
-
 400-621-6806
400-621-6806 -
 13116038708(微信同号)
13116038708(微信同号) -
 周一至周五 8:30-18:00
周一至周五 8:30-18:00 -


-
 0
0
-





